
【题目】(1)常温下,甲、乙两种溶液体积都为1L,甲中溶有0.1molCH3COOH,乙中溶有0.1molHCl和0.1molCH3COOH,测得甲溶液中c(CH3COO-)=a molL-1,乙溶液中c(CH3COO-)=b molL-1,分别用含a、b的代数式表示醋酸的电离平衡常数___、___。(忽略水的电离)两溶液中CH3COOH的电离平衡常数甲__乙(填“>”“<”“=”,下同);两溶液中CH3COOH的电离度甲___乙;a和b的值:a___b。
(2)已知 常温下CH3COOH的电离平衡常数Ka=1.8×10-5,在0.1mol/L的CH3COOH溶液中加入NaOH溶液,当溶液中c(CH3COO-) =c(CH3COOH)时,该溶液pH=___(可用对数形式表示),当溶液的pH =7时,c(CH3COO-)/c(CH3COOH)=___。
【答案】a2/(0.1-a) b(0.1+b)/(0.1-b) = > > -lg(1.8×10-5)(或5-lg1.8) 180
【解析】
弱电解质在溶液中的电离常数,只受温度变化的影响,不受溶液性质的影响。所以,往醋酸溶液中加入盐酸,醋酸的电离常数不变。
(1) 甲溶液中 CH3COOH![]() CH3COO- + H+
CH3COO- + H+
起始量 0.1mol/L 0 0
变化量 a mol/L a mol/L a mol/L
平衡量 (0.1-a )mol/L a mol/L a mol/L
K甲=![]() ;
;
乙溶液中 CH3COOH![]() CH3COO- + H+
CH3COO- + H+
起始量 0.1mol/L 0 0.1mol/L
变化量 b mol/L b mol/L b mol/L
平衡量 (0.1-b )mol/L b mol/L (0.1+b)mol/L
K乙=![]() ;
;
因温度不变,所以平衡常数不变,两溶液中CH3COOH的电离平衡常数甲=乙;由于乙溶液中盐酸电离出的H+抑制了醋酸的电离,所以醋酸的电离度减小,从而得出两溶液中CH3COOH的电离度:甲>乙;两溶液中c(CH3COO-)的甲>乙,即a>b,答案为:a2/(0.1-a);b(0.1+b)/(0.1-b);=;>;>;
(2)K= [c(H+) c(CH3COO-)]/ c(CH3COOH)= 1.8×10-5,当溶液中c(CH3COO-) =c(CH3COOH)时,c(H+)=1.8×10-5mol/L pH=-lg c(H+)=5-lg1.8;当溶液的pH =7时,K= [c(H+) c(CH3COO-)]/ c(CH3COOH)= 1.8×10-5,c(CH3COO-)/c(CH3COOH)= 1.8×10-5/10-7=180,答案为:-lg(1.8×10-5)(或5-lg1.8);180。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】一种柔性水系锌电池为可充电电池,以锌盐溶液作为电解液,其原理如图所示。下列说法正确的是( )
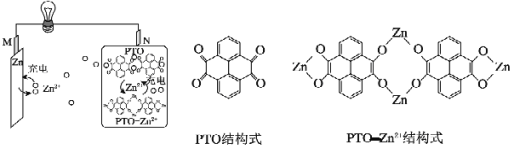
A.充电时,Zn2+向N极移动
B.充电时,N极的电极反应式为PTO—Zn2+-8e-= 2PTO + 4Zn2+
C.若维持电流强度为0.5A,放电10分钟,理论上消耗Zn的质量约为0.20g(已知F=96500C·mol-1)
D.放电时,每生成1mol PTO—Zn2+,M极溶解Zn的质量为65g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化石燃料及其使用的一些说法中不正确的是( )
A. 煤的气化是指将固态煤粉碎后高温下变为气态,以使煤燃烧时能与氧气充分接触而完全燃烧
B. 天然气除可用作清洁能源外,也可用于合成氨和生产甲醇等
C. 石油分馏得到的汽油和石油催化裂化得到的汽油其成分不相同
D. 化石燃料也是重要的化工原料,乙烯和苯就是分别来自于石油和煤的基本化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了证明二氧化硫和氯气的漂白性,设计了如下图所示的实验装置:
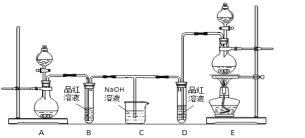
他们制备二氧化硫和氯气所依据的原理分别是:
Na2SO3+H2SO4 = Na2SO4+H2O+SO2↑
MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)用来制取氯气的装置是______(填字母),反应中浓盐酸所表现出________________性质。
(2)反应开始一段时间后,B、D试管中的品红溶液均退色。停止通气后,再给B、D两个试管分别加热____ (填" B”或“D")试管中无明显现象。
(3)装置C的作用是________________________;
(4)若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是____________________________;
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不退色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。

(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下,一容积不变的密闭容器里充满硫化氢和氧气的混合气体,点燃恰好完全反应后,恢复至原状态,压强变为原来的![]() ,计算原混合气体的硫化氢和氧气的体积比________。
,计算原混合气体的硫化氢和氧气的体积比________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ/mol
O2(g)=H2O(l) ΔH=-285.8 kJ/mol
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol
O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③C(s)+![]() O2(g)=CO(g) ΔH=-110.5 kJ/mol
O2(g)=CO(g) ΔH=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是_______。
(2)H2的燃烧热为_______,C的燃烧热为_______。
(3)燃烧10 g H2生成液态水,放出的热量为_______。
(4)CO的燃烧热为_____________,其热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1)配制100mL 0.1000mol/L NaOH标准溶液。
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.1000 | 30.05 | 20.00 |
2 | 0.1000 | 29.95 | 20.00 |
3 | 0.1000 | 28.20 | 20.00 |
①滴定达到终点的判断是__。
②根据上述数据,可计算出该盐酸的浓度约为___________(保留两位小数)。
③排去碱式滴定管中气泡的方法应采用操作______,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
甲.![]() 乙.
乙.![]() 丙.
丙.![]()
④在上述实验中,下列操作(其他操作正确)会造成盐酸浓度测定结果偏高的有_____。
A.碱式滴定管使用前,水洗后未用NaOH标准溶液润洗
B.锥形瓶水洗后未干燥
C.滴定前读数时正确,滴定后俯视刻度线
D.碱式滴定管尖嘴部分有气泡,滴定后消失
⑤如图是某次滴定时的滴定管中的液面,其读数为__________mL。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com