
【题目】已知0.1 mol某单质与足量的硫在一定条件下充分反应后质量增加了1.6 g,则该单质可能是( )
A.钙B.铜
C.铁D.铝
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用KMnO4氧化盐酸溶液,反应方程式如2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,计算:
(1)参加反应的HCl的物质的量________________
(2)反应中被氧化的HCl的物质的量__________________
(3)并用双线桥标出电子转移的方向和数目___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向25ml氢氧化钠标准溶液中逐滴加入0.2mol·L1的一元酸HA溶液,PH变化曲线如下图所示:
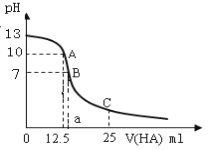
(1)该氢氧化钠溶液的物质的量浓度为__________mol·L1。
(2)A点对应酸的体积为12.5ml,则所得混合溶液中由水电离出的c(OH)= _______mol·L1。
(3)HA是____酸(选填“强”、“弱”)。
(4) 在B点所得混合溶液中,c(Na+)、c(A)、c(H+)、c(OH) 的大小的顺序是_____________。
(5)在C点所得混合溶液中,下列说正确的是________。
A.HA的电离程度小于NaA的水解程度
B.离子浓度由大到小的顺序是c(Na+)>c(A)>c(H+)>c(OH)
C.c(Na+) + c(H+) = c(A-) + c(OH)
D.c(HA) + c(A) = 0.2mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知煤的近代结构模型如图所示。
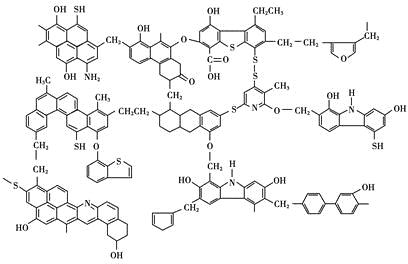
回答下列问题:
(1)从煤的结构模型来看,煤是工业上获得____________的重要来源。
(2)我国大约70%的煤是直接用于燃烧的。从煤的结构模型来看,在提供热量的同时产生大量的____________、____________等气体物质,造成严重的大气污染。
(3)“型煤”技术不仅可以减少87%的废气排放量,烟尘排放量也可减少80%,致癌物苯并[α]芘的排放量也减少,同时节煤20%~30%。“型煤”技术的原理是利用固硫剂在燃烧过程中生成稳定的硫酸盐。某“型煤”生产厂利用石灰石作固硫剂,试用化学方程式表示其固硫过程________________、________________。
(4)为了解决煤燃烧所造成的污染问题和提高煤的利用价值,煤资源的综合利用方法还有____________、____________、____________等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月1曰,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态Cr原子的价电子排布式为___。
(2)实验室常用KSCN溶液、苯酚(![]() )检验Fe3+。
)检验Fe3+。
①第一电离能:N___O(填“>”或“<”)。
②1mol苯酚中含有的σ数目为___。
③苯酚中的氧原子和碳原子均采用相同的杂化方式,其类型为___。
④从结构的角度分析苯酚的酚羟基有弱酸性的原因为___。
(3)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的___空隙和___空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B(![]() ,0,
,0,![]() ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___。
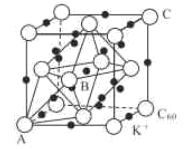
(4)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体Ni2与Ni3+产的最简整数比为___,晶胞参数为428pm,则晶体密度为___gcm-3(NA表示阿伏加德罗常数的值,列出表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,甲、乙两种溶液体积都为1L,甲中溶有0.1molCH3COOH,乙中溶有0.1molHCl和0.1molCH3COOH,测得甲溶液中c(CH3COO-)=a molL-1,乙溶液中c(CH3COO-)=b molL-1,分别用含a、b的代数式表示醋酸的电离平衡常数___、___。(忽略水的电离)两溶液中CH3COOH的电离平衡常数甲__乙(填“>”“<”“=”,下同);两溶液中CH3COOH的电离度甲___乙;a和b的值:a___b。
(2)已知 常温下CH3COOH的电离平衡常数Ka=1.8×10-5,在0.1mol/L的CH3COOH溶液中加入NaOH溶液,当溶液中c(CH3COO-) =c(CH3COOH)时,该溶液pH=___(可用对数形式表示),当溶液的pH =7时,c(CH3COO-)/c(CH3COOH)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应2AB+3C,在下列四种状态中,处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | vA=2 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
B | vA=2 mol·L-1·min-1 | vC=2 mol·L-1·min-1 |
C | vA=1 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
D | vA=1 mol·L-1·min-1 | vC=1.5 mol·L-1·min-1 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上联合生产碳酸氢钠和氯代烃的工艺流程如图所示,在生产NaHCO3的过程中完成乙烯氯化,下列叙述错误的是( )
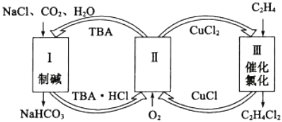
A.过程Ⅰ中的TBA替代了侯德榜制碱法中的氨气
B.在过程Ⅱ中实现了TBA、CuCl2的再生
C.过程Ⅲ中的反应方程式为C2H4+2CuCl2![]() C2H4C12+2CuC1
C2H4C12+2CuC1
D.理论上每生成1 mol NaHCO3,可得到1 mol C2H4C12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com