
【题目】恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g).反应过程中测定的部分数据如表:
反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
0 | 2.0 | 2.0 | 0 |
2 | 0.8 | ||
4 | 1.2 | ||
6 | 1.2 | 2.8 |
下列说法正确的是( )
A.0~2 min内的平均速率为υ (CO)=0.6 mol/(Lmin)
B.4 min后,平衡移动的原因可能是向容器中加入了2.0 mol的SO2
C.若升高温度,反应的平衡常数变为1.0,则正反应为放热反应
D.其他条件不变,若起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol
【答案】B
【解析】解:A.由表中时间可知,0~2min内CO的物质的量变化量为2mol﹣0.8mol=1.2mol,则v(CO)= ![]() =0.3 molL﹣1min﹣1 , 故A错误;
=0.3 molL﹣1min﹣1 , 故A错误;
B.由表中数据结合方程式可知,0~2min内CO、CO2、SO2的物质的量变化量为2mol﹣0.8mol=1.2mol,4~6min时,变化了0.4mol,所以平衡移动的原因可能是向容器中加入了2.0 mol的SO2 , 故B正确;
C.由表中时间可知,
MgSO4(s) | + | CO(g) |
| MgO(s) | + | CO2(g) | + | SO2(g) |
开始(mol): | 2 | 0 | 0 | |||||
变化(mol): | 1.2 | 1.2 | 1.2 | |||||
平衡(mol): | 0.8 | 1.2 | 1.2 |
故该温度下平衡常数k= ![]() =0.9,若升高温度,反应的平衡常数变为l.00,则平衡向正反应方向移动,所以正反应为吸热反应,故C错误;
=0.9,若升高温度,反应的平衡常数变为l.00,则平衡向正反应方向移动,所以正反应为吸热反应,故C错误;
D.保持其他条件不变,起始时向容器中充入1.00mol MgSO4和1.00molCO,等效为原平衡体积增大一倍,降低压强,平衡向正方向移动,故到达平衡时n(CO2)>0.60mol,故D错误;
故选B.
【考点精析】根据题目的已知条件,利用化学平衡状态本质及特征的相关知识可以得到问题的答案,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


科目:高中化学 来源: 题型:
【题目】下列热化学方程式表达正确的是(![]() 的绝对值均正确)
的绝对值均正确)
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和热)
C. S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反应热)
D. 2NO2=O2+2NO △H= +116.2kJ/mol (反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种香料,存在于金橘中,可用如下路线合成: 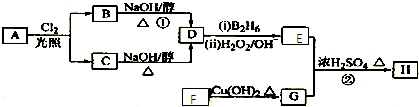
已知:R﹣CH=CH2 ![]() R﹣CH2CH2OH(B2H6为乙硼烷)
R﹣CH2CH2OH(B2H6为乙硼烷)
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以产生88g CO2和45g H2O.A的分子式是
(2)B和C均为一氯代烃,它们的名称(系统命名)分别为
(3)在催化剂存在下1mol F与2mol H2反应,生成3﹣苯基﹣1﹣丙醇.F的结构简式是
(4)反应①的反应类型是;
(5)反应②的化学方程式为
(6)写出所有与G具有相同官能团的G的芳香类同分异构体的结构简式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于 棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2﹣、Cl﹣等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl﹣没有画出).则下列分析不正确的是( ) 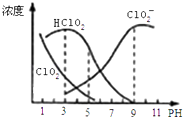
A.亚氯酸钠在碱性条件下较稳定
B.25℃时,HClO2的电离平衡常数的数值Ka=10﹣6
C.使用该漂白剂的最佳pH为3
D.25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2﹣)+2c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NaCl、MgCl2、MgSO4的混合溶液中,c(Na+)=0.10mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.20mol/L,则c(SO42-)为
A. 0.10mol/L B. 0.15mol/L C. 0.20mol/L D. 0.25mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中的△H可表示燃烧热的是( )
A.H2(g)+Cl2(g)═2HCl(g)△H=﹣184.8KJ/mol
B.C2H4(g)+O2(g)═2CO2(g)+2H2O(l)△H=﹣1411.0KJ/mol
C.CH4(g)+ ![]() O2(g)═CO(g)+2H2O(l)△H=﹣6071.3KJ/mol
O2(g)═CO(g)+2H2O(l)△H=﹣6071.3KJ/mol
D.H2(g)+ ![]() O2(g)═H2O(g)△H=﹣241.8KJ/mol
O2(g)═H2O(g)△H=﹣241.8KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水三氯化铁易升华,有强烈的吸水性,是一种用途比较广泛的盐.
(1)实验室中可将FeCl3溶液、、过滤、洗涤干燥得FeCl36H2O;再将FeCl36H2O在HCl的气氛中加热脱水,得到无水FeCl3 .
(2)利用工业FeCl3制取纯净的草酸铁晶体的实验流程如图所示: 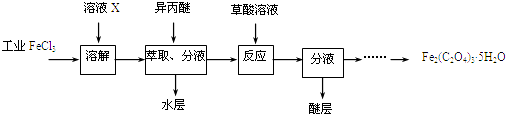
①为抑制FeCl3水解,溶液X为 .
②上述流程中FeCl3能被异丙醚萃取,其原因是;检验萃取、分液后所得水层中是否含有Fe3+的方法是 .
③所得Fe2(C2O4)35H2O需用冰水洗涤,其目的是 .
④为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4 , KMnO4标准溶液应置于如图所示仪器(填“甲”或“乙”) 中;下列情况会造成实验测得Fe2(C2O4)35H2O含量偏低的是 . ![]()
a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是中学化学常见物质,它们在一定条件下有A+B→C+D的转化关系.
(1)若A为金属铝,B为氧化铁,该反应的一种用途是 .
(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体,且该反应是工业上制取硝酸的重要反应之一,该反应的化学反应方程式为 .
(3)若A是淡黄色粉末,常用作供氧剂,C为强碱,则该反应的化学反应方程式为 .
(4)若A、B、D都是有机化合物,其中A、B是家庭厨房中常见调味品的主要成分,且A 的相对分子质量比B大14.
①该反应的化学反应方程式为 .
②某种以B为反应物的新型电池如右所示,该电池的负极的电极反应式为 .
(5)ClO2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ClO2被还原为Cl﹣ , 该反应的离子方程式为 . 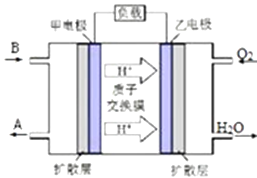
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com