
【题目】锰及其化合物间的转化如图。
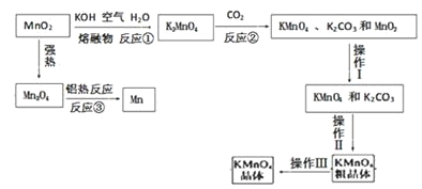
请回答下列问题:
(1)反应①发生的主要化学反应的方程式为:_____。
(2)粗KMnO4晶体中含有少量的K2CO3,为了得到纯的KMnO4晶体,操作Ⅲ的名称为_____。
(3)测定高锰酸钾样品纯度采用硫酸锰滴定:向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀。当____,表明达到滴定终点。
(4)已知:常温下,Ksp[Mn(OH)2]=2.4×10-13。工业上,调节pH可以沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2+)=_____。
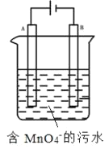
(5)如图,用Fe、C作电极电解含MnO4-的碱性污水,使之转化为Mn(OH)2沉淀除去。A电极是____(填“Fe”或“C”),该电极的产物使碱性污水中MnO4-转化为沉淀除去的离子方程式为____。
【答案】2MnO2+4KOH+O2![]() 2K2MnO4+2H2O 重结晶(或溶解、蒸发浓缩、冷却结晶) 滴入最后一滴硫酸锰溶液,高锰酸钾溶液由紫红色刚好褪色且半分钟不恢复 2.4×10-5mol/L Fe 5Fe2++MnO4-+9OH-+4H2O=5Fe(OH)3↓+Mn(OH)2↓
2K2MnO4+2H2O 重结晶(或溶解、蒸发浓缩、冷却结晶) 滴入最后一滴硫酸锰溶液,高锰酸钾溶液由紫红色刚好褪色且半分钟不恢复 2.4×10-5mol/L Fe 5Fe2++MnO4-+9OH-+4H2O=5Fe(OH)3↓+Mn(OH)2↓
【解析】
将MnO2和KOH粉碎混合,目的是增大反应物的接触面积,加快反应速率,然后将混合物熔融并通入空气,根据流程图知,二者反应生成K2MnO4,根据元素守恒知还生成H2O,K2MnO4和CO2反应生成KMnO4、K2CO3、MnO2,KMnO4、K2CO3易溶于水而MnO2难溶于水,将KMnO4、K2CO3、MnO2溶于水然后过滤得到KMnO4、K2CO3混合溶液,再根据KMnO4、K2CO3溶解度差异采用浓缩结晶、趁热过滤得到KMnO4粗晶体,重结晶得到纯KMnO4晶体。
(1)由工艺流程转化关系可知,MnO2、KOH的熔融混合物中通入空气时发生反应生成K2MnO4,根据元素守恒还应生成水,则反应化学方程式为2MnO2+4KOH+O2![]() 2K2MnO4+2H2O;
2K2MnO4+2H2O;
(2)粗KMnO4晶体中含有少量的K2CO3,为了得到纯的KMnO4晶体,操作Ⅲ是粗晶体提纯,操作的名称为重结晶;
(3)测定高锰酸钾样品纯度采用硫酸锰滴定:向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀,当高锰酸钾溶液由紫红色刚好褪色且半分钟不恢复,表明达到滴定终点;
(4)当pH=10时,c(OH-)=1×10-4 mol/L,根据Ksp[Mn(OH)2]=c(Mn2+)c2(OH-),可知c(Mn2-)=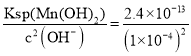 =2.4×10-5mol/L;
=2.4×10-5mol/L;
(5)用Fe、C作电极电解含MnO4-的污水,需要还原剂,电解池中铁做阳极失电子生成亚铁离子,亚铁离子还原高锰酸根离子生成锰离子,在碱溶液中生成氢氧化锰,反应的离子方程式为:5Fe2++MnO4-+9OH-+4H2O=5Fe(OH)3↓+Mn(OH)2↓。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】将一定量的氨基甲酸铵置于密闭容器中,一定条件下发生反应: H2NCOONH4(s) ![]() CO2(g) + 2NH3(g) 。下列不能作为平衡状态判定依据的是
CO2(g) + 2NH3(g) 。下列不能作为平衡状态判定依据的是
A.混合气体的密度保持不变
B.混合气体的平均摩尔质量保持不变
C.二氧化碳浓度保持不变
D.混合气体的压强保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要准确掌握化学基本概念和研究方法。按要求回答下列问题:
(1)下列是某同学对有关物质进行分类的列表:
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
第一组 | Na2CO3 | H2SO4 | NaHCO3 | CaO | CO2 |
第二组 | NaOH | HCl | NaCl | Na2O | CO |
第三组 | NaOH | CH3COOH | CaSO4 | H2O2 | SO2 |
每组分类均有错误,其错误的物质分别是________、________、________(填化学式)。
(2)胶体和溶液的本质区别是______________;鉴别胶体和溶液所采用的方法是观察是否能发生______________效应。
(3)下列3个反应,按要求填写相关量。
①2Na2O2+2H2O![]() 4NaOH+O2↑反应中,每生成1分子 O2转移________个电子;
4NaOH+O2↑反应中,每生成1分子 O2转移________个电子;
②2NaHCO3![]() Na2CO3+H2O+CO2↑反应中,每消耗168 gNaHCO3,生成________g CO2;
Na2CO3+H2O+CO2↑反应中,每消耗168 gNaHCO3,生成________g CO2;
③Cl2+H2O![]() HCl+HClO反应中,每消耗10分子 Cl2,转移________个电子。
HCl+HClO反应中,每消耗10分子 Cl2,转移________个电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素,W与O2反应能生成两种氧化物。
(1)写出W与O2反应的化学方程式:_________、_________。
(2)W与Y可形成化合物W2Y,该化合物的化学式为____,X与Z可形成化合物XZ2,该化合物的名称为____。
(3)比较Y、Z气态氢化物的稳定性:____>____(用化学式表示)。
(4)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应I:CH3OH(g) ![]() HCHO(g)+H2(g) △H1
HCHO(g)+H2(g) △H1
反应II:CH3OH(g)+1/2O2(g) ![]() HCHO(g)+H2O(g) △H2= —156.6kJ/mol
HCHO(g)+H2O(g) △H2= —156.6kJ/mol
反应III:2H2(g)+O2(g) ![]() 2H2O(g) △H3= —483.6kJ/mol
2H2O(g) △H3= —483.6kJ/mol
(1)计算反应I的反应热△H1=_____________。
(2)750K下,在恒容密闭容器中,发生反应CH3OH(g) ![]() HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
II. CO2既是温室气体,也是重要的化工原料,以CO2为原料可合成多种有机物。
(3)二氧化碳与氢气在催化剂作用下可制取低碳烯烃。在一恒容密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。

①其他条件不变,起始时若按1molCO2、2molH2进行投料,则CO2的转化率将________(填“增大”“ 减小”或“不变”)。
②△H______ (填“>”“<”或“不能确定”)0。
③若测试中体系内无氧气产生,试结合图示推断热稳定性:C2H4_________(填“>” “<”或“不能
确定”)H2O。
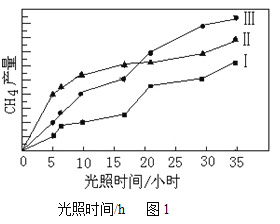
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化见图1。在15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为______________(填序号)。
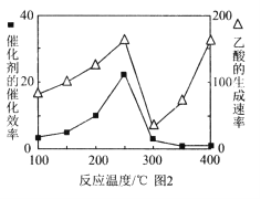
(5)以 TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图2。乙酸的生成速率主要取决于温度影响的范围是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在好氧菌和厌氧菌作用下废液中NH4+能转化为N2(g)和H2O(l),示意图如下:
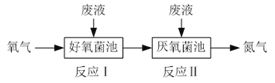
反应I:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH1=a kJ·mol-1
反应II:5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) ΔH2=b kJ·mol-1
下列说法正确的是
A. 两池发生的反应中氮元素只被氧化
B. 两池中投放的废液体积相等时NH4+能完全转化为N2
C. 常温常压下,反应II中生成22.4 L N2转移的电子数为3.75×6.02×1023
D. 4NH4+(aq)+3O2(g)=2N2(g)+4H+(aq)+6H2O(l) ΔH=![]() (3a+b) kJ·mol-1
(3a+b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,对含有氮氧化物的废气进行处理。
(1)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O①
2NO2+2NaOH===NaNO2+NaNO3+H2O②
在反应①中,氧化剂是________________,还原剂是________________,在反应②中,氧化剂和还原剂的物质的量之比为___________________________________________。
(2)汽车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成N2和CO2,该反应的化学方程式为____________________________。
(3)由反应②判断二氧化氮是否为酸性氧化物(填“是”或“不是”)________,原因是________________________________________________________________________。
(4)目前有一种治理方法是在一定条件下,用氨气将氮氧化物转化为无污染的物质,请写出该反应的化学方程式:________________________________________________,该反应中,氧化剂是________,氧化产物是________,生成1.4 mol氮气时,转移电子的物质的量为_______________________________________________。
(5)为了保护环境,工业上常通入NH3使氮的氧化物和氨转化为无毒的N2。现有NO2和NO的混合气体3 L,通入3 L(同温同压下)NH3,恰好使其完全转化为N2,则原混合气体中NO2和NO的物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的CO和CO2相比较,下列叙述中正确的是( )
A.物质的量为1:1B.体积比为11:7
C.原子数比为1:1D.密度比为11:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间的转化关系如图所示。已知:淀粉遇单质碘变蓝。下列说法中,不正确的是( )
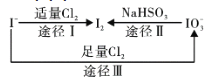
A.氧化性的强弱顺序为:Cl2>IO3->I2
B.途径Ⅱ中若生成1mol I2,消耗4mol NaHSO3
C.一定条件下,I-与IO3-反应可能生成I2
D.向含I-的溶液中通入Cl2,所得溶液加入淀粉溶液不一定变为蓝色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com