
【题目】I.甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应I:CH3OH(g) ![]() HCHO(g)+H2(g) △H1
HCHO(g)+H2(g) △H1
反应II:CH3OH(g)+1/2O2(g) ![]() HCHO(g)+H2O(g) △H2= —156.6kJ/mol
HCHO(g)+H2O(g) △H2= —156.6kJ/mol
反应III:2H2(g)+O2(g) ![]() 2H2O(g) △H3= —483.6kJ/mol
2H2O(g) △H3= —483.6kJ/mol
(1)计算反应I的反应热△H1=_____________。
(2)750K下,在恒容密闭容器中,发生反应CH3OH(g) ![]() HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
II. CO2既是温室气体,也是重要的化工原料,以CO2为原料可合成多种有机物。
(3)二氧化碳与氢气在催化剂作用下可制取低碳烯烃。在一恒容密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。

①其他条件不变,起始时若按1molCO2、2molH2进行投料,则CO2的转化率将________(填“增大”“ 减小”或“不变”)。
②△H______ (填“>”“<”或“不能确定”)0。
③若测试中体系内无氧气产生,试结合图示推断热稳定性:C2H4_________(填“>” “<”或“不能
确定”)H2O。
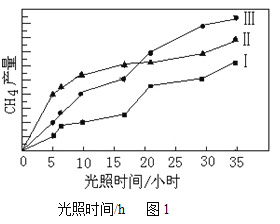
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化见图1。在15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为______________(填序号)。
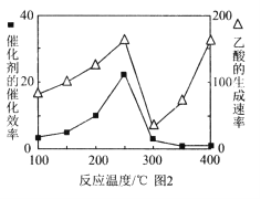
(5)以 TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图2。乙酸的生成速率主要取决于温度影响的范围是______________________。
【答案】+85.2kJ·mol-1 p0(1+a) 50.5kPa 减小 < < v(Ⅱ)>v(Ⅲ)>v(Ⅰ) 300℃~400℃
【解析】
(1)根据盖斯定律进行计算△H2;
(2)根据三段式进行分析计算;压强之比等于物质的量之比,根据平衡常数Kp= ![]() 进行计算;
进行计算;
(3)①其它条件不变,起始时若按1molCO2、2 molH2进行投料,与原平衡相比,相当于减小氢气的浓度,据此分析CO2的转化率变化情况;
②△H只与温度有关,由图升高温度,氢气的量增加,平衡逆向移动,正反应放热;
③若测试中体系内无氧气产生,结合图示温度高于TA℃时,n(H2)大幅提高,说明C2H4受热分解生成氢气,进而推断C2H4和H2O热稳定性大小;
(4)由图2可知,在0~15h内,甲烷的物质的量变化量为△n(Ⅱ)>△n(Ⅲ)>△n(Ⅰ),从而计算0~15h内,CH4的平均生成速率,进而比较大小;在不同催化剂(I、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化,由图1可得:在15小时内,甲烷的物质的量变化量为△n(Ⅱ)>△n(Ⅲ)>△n(Ⅰ),据此判断CH4的平均生成速率;
(5)在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图2。温度超过250℃时,催化剂的催化效率降低,在300℃时失去活性,所以温度高于300℃时,乙酸的生成速率升高是由温度升高导致的,据此进行分析。
(1)反应I:CH3OH(g) ![]() HCHO(g)+H2(g) △H1
HCHO(g)+H2(g) △H1
反应II:CH3OH(g)+1/2O2(g) ![]() HCHO(g)+H2O(g) △H2= —156.6kJ/mol
HCHO(g)+H2O(g) △H2= —156.6kJ/mol
反应III:2H2(g)+O2(g) ![]() 2H2O(g) △H3= —483.6kJ/mol
2H2O(g) △H3= —483.6kJ/mol
根据盖斯定律,反应I=反应Ⅱ-反应III,计算反应I的反应热△H1=—156.6kJ/mol-(—483.6kJ/mol)=+85.2kJ·mol-1;
(2)若起始压强为P0,达到平衡转化率为α,
CH3OH(g)![]() HCHO(g)+H2(g)
HCHO(g)+H2(g)
起始(mol) 1 0 0
变化(mol) a a a
平衡(mol) 1-a a a
压强之比等于物质的量之比,则p0:P平=1:(1+a),P平=p0(1+a);当P0=101kPa,测得α=50.0%,该反应平衡常数Kp=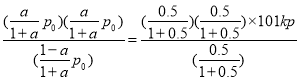 =50.5kPa;
=50.5kPa;
(3)①其他条件不变,起始时若按1molCO2、2 molH2进行投料,与原平衡相比,相当于减小氢气的浓度,则CO2的转化率将减小;
②△H只与温度有关,由图升高温度,氢气的量增加,平衡逆向移动,正反应放热,△H<0;
③若测试中体系内无氧气产生,结合图示温度高于TA℃时,n(H2)大幅提高,说明C2H4受热分解生成氢气,推断热稳定性:C2H4<H2O;
(4)由图2可知,在0~15h内,甲烷的物质的量变化量为△n(Ⅱ)>△n(Ⅲ)>△n(Ⅰ),故在0~15h内,CH4的平均生成速率v(Ⅱ)>v(Ⅲ)>v(Ⅰ);在不同催化剂(I、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化,由图1可得:在15小时内,甲烷的物质的量变化量为△n(Ⅱ)>△n(Ⅲ)>△n(Ⅰ),CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为v(Ⅱ)>v(Ⅲ)>v(Ⅰ)。
(5)在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图2。温度超过250℃时,催化剂的催化效率降低,在300℃时失去活性,所以温度高于300℃时,乙酸的生成速率升高是由温度升高导致的,故乙酸的生成速率主要取决于温度影响的范围是300℃~400℃。


科目:高中化学 来源: 题型:
【题目】二氧化硅是一种化工原料,可以制备一系列物质。下列说法正确的是( )
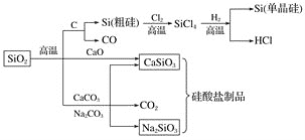
A.图中所有反应都不属于氧化还原反应
B.硅酸盐的化学性质稳定,常用于制造光导纤维
C.可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸钙
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
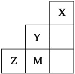
A.电负性:Z>M>Y
B.离子半径:M->Z2->Y-
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子最外层电子轨道表示式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,分别向浓度均为0.1 mol/L,体积均为20 mL的HX和HY的溶液中滴入等物质的量浓度的氨水,溶液中水电离出的c(H+)与加入氨水的体积变化关系如图所示。下列说法正确的是
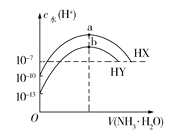
A. HX的电离方程式为HX![]() H++X
H++X
B. b点时溶液中c(![]() )=c(Y)>c(H+)=c(OH)
)=c(Y)>c(H+)=c(OH)
C. HX的电离平衡常数约为1×107 mol/L
D. a、b两点对应溶液中存在的微粒种类数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有1个未成对电子,次外层有2个电子,其元素符号为____。
(2)B元素是前四周期基态原子中的未成对电子数最多的,其基态原子的价电子排布图为_____。
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,该电子的轨道形状为_____,C的基态原子核外电子占用了_____个原子轨道,被其占用的最外电子层本身有_____个能级。
(4)D元素是自然界中含量居第二位的金属元素,其+3价离子简化的核外电子排布式为______,该离子比同元素的其它离子更稳定的原因是_____。
(5)E元素原子最外层电子数是电子层数的3倍,其核外共有_____种能量不同的电子,写出E的具有18个电子的氢化物的电子式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰及其化合物间的转化如图。
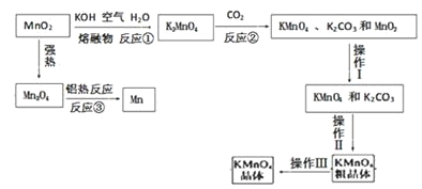
请回答下列问题:
(1)反应①发生的主要化学反应的方程式为:_____。
(2)粗KMnO4晶体中含有少量的K2CO3,为了得到纯的KMnO4晶体,操作Ⅲ的名称为_____。
(3)测定高锰酸钾样品纯度采用硫酸锰滴定:向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀。当____,表明达到滴定终点。
(4)已知:常温下,Ksp[Mn(OH)2]=2.4×10-13。工业上,调节pH可以沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2+)=_____。
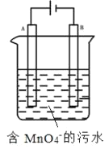
(5)如图,用Fe、C作电极电解含MnO4-的碱性污水,使之转化为Mn(OH)2沉淀除去。A电极是____(填“Fe”或“C”),该电极的产物使碱性污水中MnO4-转化为沉淀除去的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的二氧化碳分别通入:①氯化钙溶液 ②硅酸钠溶液 ③氢氧化钙溶液 ④饱和碳酸钠溶液。最终溶液中有白色沉淀析出的是( )
A.①②③④
B.②④
C.①②③
D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焰色实验过程中,铂丝的清洗和灼烧与钾焰色实验的观察两项操作如图所示,下列叙述中不正确的是( )

A.每次实验中都要先将铂丝灼烧到火焰颜色,再蘸取被检验物质
B.钾的焰色实验要透过蓝色钴玻璃观察
C.焰色实验是某种金属元素灼烧时所具有的特殊颜色,是化学变化
D.没有铂丝可用无锈铁丝代替进行实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式正确的是( )
A. 用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:Na2S2O3+2H+=SO2↑+S↓+2Na++H2O
B. 氢氧化亚铁暴露于空气中会变色:4Fe(OH)2+O2+2H2O=4Fe(OH)3
C. 向Ca(ClO)2溶液中通入过量CO2制取次氯酸: Ca2++ClO-+H2O+CO2=2HClO+CaCO3↓
D. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com