
【题目】将一定量的氨基甲酸铵置于密闭容器中,一定条件下发生反应: H2NCOONH4(s) ![]() CO2(g) + 2NH3(g) 。下列不能作为平衡状态判定依据的是
CO2(g) + 2NH3(g) 。下列不能作为平衡状态判定依据的是
A.混合气体的密度保持不变
B.混合气体的平均摩尔质量保持不变
C.二氧化碳浓度保持不变
D.混合气体的压强保持不变
科目:高中化学 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+,O2,NO3-等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。下列说法错误的是( )

A. 反应①②③④均在正极发生
B. 单位时间内,三氯乙烯脱去amolCl时ne=amol
C. ④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D. 增大单位体积水体中小粒径ZVI的投入量,可使nt增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应与能量的说法正确的是( )
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH=-216kJ·mol-1,E反应物<E生成物
B.CaCO3(s)=CaO(s)+CO2(g) ΔH=+178.2kJ·mol-1,E反应物<E生成物
C.2HCl(g)=H2(g)+Cl2(s) ΔH=+92.3kJmol-1,1molHCl在密闭容器中分解后放出92.3kJ的能量
D.将0.5molN2和1.5molH2置于密闭的容器中充分反应后生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ·mol-1
2NH3(g) ΔH=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生。第二份加足量NaOH溶液加热后,收集到0.08mol气体。第三份加足量BaCl2溶液后,得到干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl-。__。
(2)由第二份进行的实验得知混合物中应含有__,其物质的量浓度为__。
(3)由第三份进行的实验可知12.54g沉淀的成分及物质的量是__。
(4)综合上述实验,你认为以下结论正确的是__。
A.该混合液中一定含有K+、NH4+![]() 、CO32-、SO42-,可能含Cl-,且n(K+)≥0.04mol
、CO32-、SO42-,可能含Cl-,且n(K+)≥0.04mol
B.该混合液中一定含有NH4+、CO32-、SO42-,可能含K+、Cl-
C.该混合液中一定含有NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl-
D.该混合液中一定含有NH4+、SO42-,可能含Mg2+、K+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅是一种化工原料,可以制备一系列物质。下列说法正确的是( )
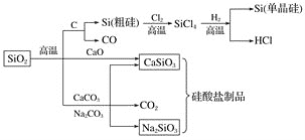
A.图中所有反应都不属于氧化还原反应
B.硅酸盐的化学性质稳定,常用于制造光导纤维
C.可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸钙
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)真空碳热还原-氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g) △H=akJ·mol-1
3AlCl(g)═2Al(l)+AlCl3(g) △H=bkJ·mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=________kJ·mol-1(用含a、b的代数式表示);
(2)已知 2SO2(g)+O2(g)=2SO3(g)△H反应过程的能量变化如图所示,已知1mol SO2(g)氧化为1mol SO3放出99kJ的热量,请回答下列问题:
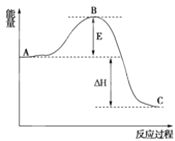
①图中A分别表示______________;
②E的大小对该反应的反应热_________(填“有”或“无”)影响;
③该反应通常用V2O5作催化剂,加V2O5会使图中B点 __________(填“升高”“降低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸的结构简式为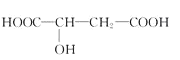 苹果酸可能发生的反应是( )
苹果酸可能发生的反应是( )
①与NaOH溶液反应;②与石蕊试液作用变红;③与金属钠反应放出气体;
④一定条件下与乙酸酯化;⑤一定条件下与乙醇酯化:
A.①②③B.①②③④C.①②③⑤D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素具有浓郁的奶香,味微甜,广泛用于食品、巧克力、冰淇淋、饮料以及日用化妆品中起增香和定香作用。下面是一种以甲苯为原料合成香兰素的路线。
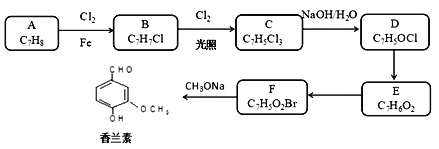
已知:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
②R-NO2![]() R-NH2。
R-NH2。
③R-NH2+R'COOR"![]() R-NHR"。
R-NHR"。
回答下列问题:
(1)下列说法不正确的是________。
A. 化合物A能发生还原反应 B. 化合物E能与碳酸氢钠反应产生气体
C. 化合物F具有弱酸性 D. 香兰素分子中最多12个原子共平面
(2)由F生成香兰素的化学反应方程式为________。
(3)E的结构简式为__________。
(4)写出以甲苯和乙酸乙酯为原料制备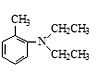 的合成路线____(用流程图表示,无机试剂任选)。
的合成路线____(用流程图表示,无机试剂任选)。
(5)写出比E分子多3个碳原子的同系物的所有同分异构体结构简式,且符合以下要求: _______。
①能使FeCl3溶液显紫色,又能发生银镜反应。②核磁共振氢谱中存在5种氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰及其化合物间的转化如图。
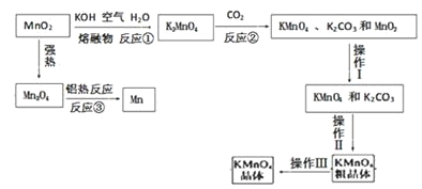
请回答下列问题:
(1)反应①发生的主要化学反应的方程式为:_____。
(2)粗KMnO4晶体中含有少量的K2CO3,为了得到纯的KMnO4晶体,操作Ⅲ的名称为_____。
(3)测定高锰酸钾样品纯度采用硫酸锰滴定:向高锰酸钾溶液中滴加硫酸锰溶液,产生黑色沉淀。当____,表明达到滴定终点。
(4)已知:常温下,Ksp[Mn(OH)2]=2.4×10-13。工业上,调节pH可以沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2+)=_____。
(5)如图,用Fe、C作电极电解含MnO4-的碱性污水,使之转化为Mn(OH)2沉淀除去。A电极是____(填“Fe”或“C”),该电极的产物使碱性污水中MnO4-转化为沉淀除去的离子方程式为____。
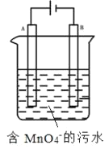
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com