
【题目】下列实验操作和所用装置能达到实验目的的是
选项 | A | B | C | D |
实验 目的 | 检验蔗糖与浓硫酸反应产物中有CO2 | 证明Fe(NO3)2溶液中存在Fe2+的水解平衡 | 检验某溶液中含有Ag+ | 比较非金属性:S>C>Si |
实验 操作 | 将浓硫酸滴入圆底烧瓶中,再将生成的气体通入澄清石灰水 | 将稀硝酸滴入Fe(NO3)2溶液中 | 向待检液中滴加足量的稀盐酸 | 将稀硫酸滴入锥形瓶中,再将生成的气体通入Na2SiO3溶液中 |
所用 装置 |
|
|
|
|
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说法正确的是( )

A. 该混合气体中一定含有乙烯
B. 该混合气体一定含有甲烷和乙炔
C. 在110℃条件下,混合气体与氧气混合,总混合气燃烧前后体积不变
D. 若混合气体由CH4和C2H4组成,则其体积比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合化学与环境相关知识,下列有关说法正确的是
A.SO2、NO2、CO2均属于大气污染物
B.酸雨是pH小于5.6的降水
C.CO2也会导致酸雨的形成
D.大气中O2含量的增加会导致温室效应加剧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把图2中的物质补充到图1中,可得到一个完整的氧化还原反应离子方程式(未配平)。

对该氧化还原反应的离子方程式,说法不正确的是
A.![]() 作氧化剂,具有氧化性
作氧化剂,具有氧化性
B.氧化性:![]() >
>![]()
C.氧化剂和还原剂的物质的量之比为5∶2
D.若有2 mol Mn2+参加反应,则转移10 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的前四周期元素。BA3能使湿润的红色石蕊试纸变蓝,A、B、C三种原子的电子数之和等于25,DC晶体中D+的3d能级上电子全充满。
请回答下列问题:
(1)以上四种元素中,第一电离能最大的是_______(填元素符号);D的基态原子的核外电子排布式为_________。
(2)在BA3、AC中,沸点较高的是______。(填化学式),其原因是_______。DA的晶体类型是_______。
(3)BA4C晶体中_____(填“含”或“不含”)配位键,在该晶体中B原子的价层电子对数为_______。

(4)化合物BC3的立体构型为_____,其中心原子的杂化轨道类型为_______。
(5)由B、D形成的晶体的晶胞如图所示,已知紧邻的B原子与D原子间的距离为acm。
①该晶胞的化学式为_________。②B元素原子的配位数为_________。
③该晶体的密度为______(用含a、NA的代数式表示,设NA为阿伏加德罗常数的数值)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用含锰废料(主要成分MnO2,含有少量Fe2O3、Al2O3、CuO、CaO等)与烟气脱硫进行联合处理并制备MnSO4的流程如下:

已知:25℃时,部分氢氧化物的溶度积常数(Ksp)如下表所示。
氢氧化物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
Ksp | 1.0×10-33 | 4.0×10-38 | 2.0×10-20 | 4.0×10-14 |
请回答:
(1)沉淀1的化学式为__________________。
(2)(NH4)2S的电子式为________________;“净化”时,加入(NH4)2S的作用为___________________。
(3)“酸化、还原”中,发生的所有氧化还原反应的离子方程式为__________________。
(4)已知:滤液3中除MnSO4外,还含有少量(NH4)2SO4。(NH4)2SO4、MnSO4的溶解度曲线如下图所示。
据此判断,操作“I”应为蒸发浓缩、____________、洗涤、干燥。

(5)工业上可用电解酸性MnSO4溶液的方法制备MnO2,其阳极反应式为________________。
(6)25.35 g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
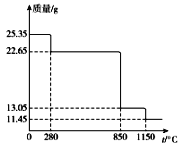
①300℃时,所得固体的化学式为______________________。
②1150℃时,反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同学们请游爷爷讲述抗战故事,爷爷打开一个珍藏的箱子,拿出一件粗棉布军装、一把黄铜军号、一副玻璃眼镜和一本记有烈士名单的塑料封皮笔记本,给同学们讲述了当年的惨烈战事。下列说法不正确的是( )
A. 棉是天然高分子材料 B. 黄铜是合金
C. 塑料是合成高分子材料 D. 玻璃是合成纤维材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应 CH4(g) + H2O(g)==CO(g)+3H2(g) △H1
已知:
①CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O(l) =H2O(g) △H=+dkJmol-1
则△H1= ___________(用含字母a、b、c、d的代数式表示)kJmol-1。
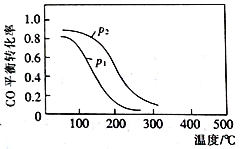
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如右图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如右图所示,200℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2_________(填“>”“<”或“ = ”)0。
②写出两条可同时提高反应速率和CO转化率的措施:________________________ 。
③下列说法正确的是____________(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
C.容器内气体压强不再变化时,反应达到最大限度
D.图中压强p12
④03 min内用CH3OH表示的反应速率v(CH3OH)=_________mol L-1·min-1。
⑤200℃时,该反应的平衡常数K =_______。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡____________(填“正向”、“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物。则下列说法错误的是

A.常温下,单质a呈气态 B.单质c具有强氧化性
C.稳定性:d>e D.f受热易分解为d和e
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com