
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
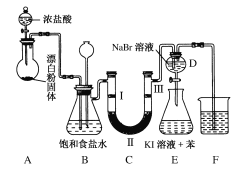
(1)装置A是氯气的发生装置,其中盛放浓盐酸的仪器名称是________,请写出该反应相应的化学方程式: ___________________________________。
(2)实验室常用以下几种方法制取氯气。
a.二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式______________。
b.氯酸钾与浓盐酸反应制氯气,该反应中氧化产物与还原产物的物质的量之比为____。
(3)装置B中饱和食盐水的作用是________;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:____________________________。
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是________(填字母编号)。
编号 | Ⅰ | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(5)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是________________,该现象________(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是_________________。
(6)装置F的作用是_________,其烧杯中的溶液不能选用下列中的________(填字母编号)。
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液
(7)氯气可制漂白粉,测定漂白粉有效成分的质量分数:称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.100 0 mol/LKI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:3ClO-+I-=3Cl-+IO3-;IO3-+5I-+3H2O=6OH-+3I2,实验测得数据如下表所示。
滴定次数 | 1 | 2 | 3 |
KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为________;若滴定过程中未充分振荡溶液,局部变浅蓝色时就停止滴定,则测定结果将________(填“偏高”“偏低”或“无影响”)。
【答案】分液漏斗 Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 5∶1 除去Cl2中的HCl B中长颈漏斗中液面上升,形成水柱,锥形瓶中液面下降 d E中溶液分为两层,上层为紫红色 不能 D溶液中可能含有过量的氯气,无法排除氯气与KI反应 吸收多余氯气,防止污染环境 b 42.9% 偏低
Mn2++Cl2↑+2H2O 5∶1 除去Cl2中的HCl B中长颈漏斗中液面上升,形成水柱,锥形瓶中液面下降 d E中溶液分为两层,上层为紫红色 不能 D溶液中可能含有过量的氯气,无法排除氯气与KI反应 吸收多余氯气,防止污染环境 b 42.9% 偏低
【解析】
浓盐酸与漂白粉反应生成氯气,由于浓盐酸具有挥发性,在制得的氯气中含有杂质HCl,用B装置的饱和食盐水去除其中的HCl,图示B装置也是安全瓶,可以监测C中是否发生堵塞;用C装置检验氯气是否具有漂白性,用D、E装置比较氯、溴、碘单质的氧化性,通过F装置进行尾气处理。
(1)装置A是氯气的发生装置,其中盛放浓盐酸的仪器名称是分液漏斗,该反应相应的化学方程式:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O。
(2)a.二氧化锰与浓盐酸混合加热发生反应制氯气,根据电子守恒、原子守恒、电荷守恒,可得该反应的离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
b.氯酸钾与浓盐酸混合也能发生反应制氯气,该反应方程式为KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,在该反应中KClO3是氧化剂,HCl是还原剂,氧化产物与还原产物都是Cl2,二者的物质的量之比为5:1。
(3)装置B中饱和食盐水的作用是除去氯气中的杂质HCl气体;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,若装置C发生堵塞,B中的现象为:B中长颈漏斗中液面上升,形成水柱,锥形瓶中液面下降;
(4)装置C的实验目的是验证氯气是否具有漂白性,通过装置B除去HCl的氯气中含有水蒸气,首先要通过湿润的有色布条,会看到褪色,说明湿润的氯气具有漂白性,然后再用无水氯化钙(U形管中应盛放固体干燥剂)干燥氯气,最后通过干燥的有色布条,看到干燥的有色布条不褪色,从而证明氯气不具有漂白性,氯气与水反应产物具有漂白性;
(5)装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是E中溶液分为两层,上层为紫红色;该现象不能说明溴单质的氧化性强于碘,原因是由于D溶液中可能含有过量的氯气,无法排除氯气与KI反应;可能是Cl2与KI发生置换反应生成I2,也可能是在装置D中Cl2与NaBr发生置换反应生成的Br2单质与KI发生置换反应生成的I2,因此不能说明溴单质的氧化性强于碘;
(6)Cl2是大气污染物,装置F的作用是吸收多余氯气,防止污染环境;
a.Cl2可以与饱和NaOH溶液发生反应,NaOH在水中溶解度大,因此可以选用;
b.Ca(OH)2微溶于水,所以饱和Ca(OH)2溶液中的溶质的含量少,不能很好的吸收多余的Cl2,因此不能选用;
c. Cl2具有氧化性,Na2SO3具有还原性,Na2SO3可以吸收氯气生成硫酸钠和HCl,因此可以选用;
d.Cl2与水反应生成HCl和HClO,饱和碳酸钠溶液与HCl反应促进氯气的吸收,饱和Na2CO3溶液可以吸收多余氯气;
故合理选项是b;
(7) 3ClO-+I-=3Cl-+IO3- ①;IO3-+5I-+3H2O=6OH-+3I2 ②
真正的滴定反应是①,①完成后,只要加入1滴碘离子就可以和生成的碘酸根发生反应②生成碘单质,碘与淀粉作用看到浅蓝色达到终点,根据滴定消耗KI溶液的体积可知:三次数据相差不大,都为有效实验数据,平均消耗KI溶液的体积=![]() mL=20.00mL,滴定消耗KI的物质的量为n(KI)=0.100 0 mol/L×0.02L=2×10-3mol,根据方程式3ClO-+I-=3Cl-+IO3-可知,n(ClO-)=3n(I-)=3×2×10-3mol=6×10-3mol,则次氯酸钙的质量为:143g/mol×0.006mol×
mL=20.00mL,滴定消耗KI的物质的量为n(KI)=0.100 0 mol/L×0.02L=2×10-3mol,根据方程式3ClO-+I-=3Cl-+IO3-可知,n(ClO-)=3n(I-)=3×2×10-3mol=6×10-3mol,则次氯酸钙的质量为:143g/mol×0.006mol×![]() =0.429g,所以质量分数为:
=0.429g,所以质量分数为:![]() ×100%=42.9%;若滴定过程中未充分振荡,溶液局部变浅蓝色时就停止滴定,导致碘化钾标准溶液的体积偏少,则KI的物质的量偏少,所以测定结果将偏低。
×100%=42.9%;若滴定过程中未充分振荡,溶液局部变浅蓝色时就停止滴定,导致碘化钾标准溶液的体积偏少,则KI的物质的量偏少,所以测定结果将偏低。


科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。
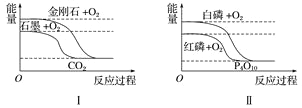
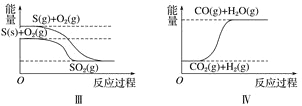
据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应 B. 白磷比红磷稳定
C. S(g)+O2(g)===SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2 则ΔH1>ΔH2 D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢毒性很大,俗称“一口闷”,工业废水中的硫化物在酸性条件下会以硫化氢的形式逸出。某课外小组以碘量法测定废水中的硫化物,实验装置如图所示,实验步骤及测定原理如下:
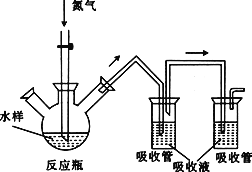
Ⅰ.取样、吹气、固硫
连接装置,打开氮气源,检查装置气密性。移取一定体积1mol·L-1乙酸锌溶液于两支吸收管中,取200mL水样于反应瓶中,通入氮气一段时间。移取10mL盐酸于反应瓶中,水浴加热,继续通入氮气。已知乙酸锌与硫化氢反应生成硫化锌沉淀(硫化氢被完全吸收)。
Ⅱ.滴定
关闭气源,往两个吸收管中各加入0.010mol·L-1的碘标准溶液100mL(过量),再加入盐酸5mL,静置。加入淀粉指示液,用0.010mol·L-1的硫代硫酸钠标准溶液对两支吸收管中的液体进行滴定。(已知:![]() )
)
回答下列问题:
(1)水浴加热的温度不能高于85℃,原因是_____________________________。
(2)加入碘标准溶液时,吸收管中发生反应的化学方程式为________________。
(3)该实验使用两个吸收管的原因是_____________________________,若只使用一个吸收管,会导致测定结果偏______________________(填“高”或“低”)。
(4)该200mL水样经吹气、固硫后,滴定操作时共消耗160mLNa2S2O3溶液,则废水中硫的含量为________mg·L-1。
(5)实验室常用FeS固体与酸反应制取H2S。实验室制取H2S时,从反应物与生成物的状态、性质和反应条件分析,下列发生装置中可选用的是________(填序号)。

(6)将二氧化氯溶液加入硫化氢溶液中,然后加入少量稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成。写出二氧化氯与硫化氢溶液反应的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。某学习小组利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
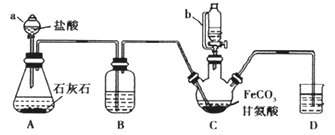
有关物质性质如下表
甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
两性化合物 | 强酸性、强还原性 |
实验过程:
Ⅰ合成:装置C中盛有0.2 mol FeCO3和200 mL 1.0 mol·L1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置C中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
(1)仪器C的名称是___________;与a相比,仪器b的优点是_______。
(2)装置B盛装的试剂为_____________。
(3)合成过程加入柠檬酸的作用是促进FeCO3溶解和______________。
(4)加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为________________。
(5)过程II中洗涤操作为________。
(6)检验产品中是否含有Fe3+的最佳试剂是_________(写化学用语)。
(7)本实验制得15.3 g 甘氨酸亚铁(M=204g/mol),则其产率是_______%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的有
①除去乙烷中混有的乙烯可以将气体通过足量KMnO4溶液;
②超导陶瓷在某一临界温度下电阻为零,可用于电力、交通、医疗等领域;
③煤燃烧时加入适量石灰石,可减少废气中SO2的量;
④可以用加热氯化铵固体,再用碱石灰除去氯化氢的方法制氨气;
⑤高分子材料中的有机物分子均呈链状结构;
⑥除去粗盐溶液中的Ca2+、Mg2+和SO![]() ,可向溶液中依次加入过量BaCl2、NaOH、Na2CO3和HCl溶液,再过滤。
,可向溶液中依次加入过量BaCl2、NaOH、Na2CO3和HCl溶液,再过滤。
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列正确的叙述有
① CO2、SO2、P2O5均为酸性氧化物
②Ca(HCO3)2 、Fe(OH)3、FeCl2均可由化合反应制得
③ 碘晶体分散到酒精中、淀粉溶于水中所形成的分散系分别为:溶液、胶体
④ 灼热的炭与CO2的反应、Ba(OH)2·8H2O与NH4Cl的反应均属于氧化还原反应,又是吸热反应
⑤ 需要通电才可进行的有:电离、电解、电泳、电镀、电化学腐蚀
⑥ 氯化铁溶液与氢氧化铁胶体具有的共同性质是:能透过滤纸,加热蒸干、灼烧后都有氧化铁生成
⑦ 按照纯净物、混合物、强电解质、弱电解质和非电解质顺序排列的是CuSO4·5H2O、盐酸、苛性钾、次氯酸、氨气
⑧ 金属元素和非金属元素形成的化合物不一定是离子化合物
A. 3个B. 4个C. 5个D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
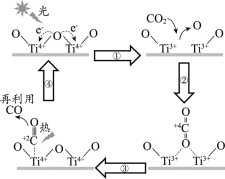
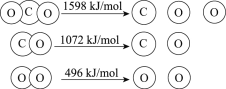
【题目】以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
下列说法正确的是
A.过程①中钛氧键断裂会释放能量
B.该反应中,光能和热能转化为化学能
C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率
D.CO2分解反应的热化学方程式为2CO2(g) =2CO(g) + O2(g) ΔH= + 30 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是一种用途广泛的精细化工产品。工业生产乙酸乙酯的方法很多,如图:

下列说法正确的是
A. 反应①、②均是取代反应
B. 反应③、④的原子利用率均为100%
C. 与乙酸乙酯互为同分异构体的酯类化合物有2种
D. 乙醇、乙酸、乙酸乙酯三种无色液体可用Na2CO3溶液鉴别
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com