
【题目】研究化学反应原理对于生产、生活及环境保护具有重要意义。请回答下列问题:
(1)常温下,物质的量浓度均为0.1mol/L的四种溶液:①NH4I;②CH3COONa;③(NH4)2SO4;④ Na2CO3,pH从大到小排列顺序为__________(填序号)。
(2)苯乙烯是工业上合成树脂、离子交换树脂及合成橡胶等的重要单体,工业上可用乙苯催化脱氢方法制备苯乙烯:
![]() 。
。
①已知乙苯(g)、苯乙烯(g)的燃烧热分别为akJ/mol,bkJ/mol,则氢气的燃烧热为___kJ/mol(用含有Q、a、b的表达式表示,其中Q、a、b均大于0)。
②在实际生产中,在恒压条件下常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),此时乙苯的平衡转化率与水蒸气的用量、压强(p)的关系如下图所示。

Ⅰ.加入水蒸气稀释剂能提高乙苯转化率的原因是__________
Ⅱ.用平衡分压代替平衡浓度计算平衡常数(Kp),其中,分压=总压×物质的量分数,则900K时的平衡常数Kp=________.
Ⅲ.改变下列条件,能使乙苯的反应速率和转化率一定增大的是_______ (填字母)。
A.恒容时加入稀释剂水蒸气
B.压强不变下,温度升至1500K
C.在容积和温度不变下充入Ar
D.选用催化效果更好的催化剂
(3)利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
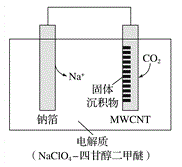
①放电时,正极的电极反应式为___________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mol 电子时,两极的质量差为______g。(假设放电前两电极质量相等)
【答案】 ④>②>①>③ Q+a-b 体系总压强不变时,充人水蒸气,相当于反应体系减压,故平衡向气体物质的量增大的方向移动,乙苯转化率增大 2p/19 B 3CO2+4Na++4e-=2Na2CO3+C 15.8
【解析】试题分析:(1)NH4I、(NH4)2SO4都是强酸弱碱盐,溶液显酸性,铵根离子浓度越大,酸性越强; CH3COONa、 Na2CO3都是强碱弱酸盐,溶液显碱性,碳酸根离子水解程度大于醋酸根离子;(2)根据盖斯定律计算氢气的燃烧热;②Ⅰ.通入水蒸气相当于减压,平衡正向移动;Ⅱ.利用“三段式”计算Kp;Ⅲ.根据影响反应速率和影响平衡移动的因素分析;(3)①放电时,正极得电子发生还原反应;②根据总反应,转移0.2mol 电子时,负极消耗0.2molNa,正极生成0.1nol Na2CO3和0.05molC ;
解析:(1)NH4I、(NH4)2SO4都是强酸弱碱盐,溶液显酸性,铵根离子浓度越大,酸性越强; CH3COONa、 Na2CO3都是强碱弱酸盐,溶液显碱性,碳酸根离子水解程度大于醋酸根离子,所以同浓度的①NH4I;②CH3COONa;③(NH4)2SO4;④ Na2CO3,pH从大到小排列顺序为④>②>①>③;(2)
①![]()
② C8H10(g)+ ![]() O2(g)
O2(g) ![]() 8CO2(g)+5H2O(l)
8CO2(g)+5H2O(l) ![]() - akJ/mol
- akJ/mol
③C8H8(g)+10 O2(g) ![]() 8CO2(g)+4H2O(l)
8CO2(g)+4H2O(l) ![]() - bkJ/mol,根据盖斯定律②-①-③,得氢气的燃烧热为(Q+a-b)kJ/mol;②Ⅰ.通入水蒸气相当于减压,平衡正向移动,所以加入水蒸气稀释剂能提高乙苯转化率;水与乙苯的比为8,压强为2P,900K时,乙苯的转化率为50%,
- bkJ/mol,根据盖斯定律②-①-③,得氢气的燃烧热为(Q+a-b)kJ/mol;②Ⅰ.通入水蒸气相当于减压,平衡正向移动,所以加入水蒸气稀释剂能提高乙苯转化率;水与乙苯的比为8,压强为2P,900K时,乙苯的转化率为50%,
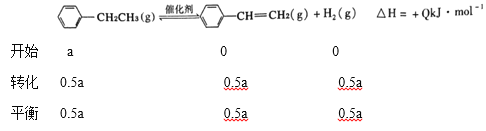
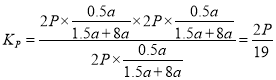 ;Ⅲ A.恒容时加入稀释剂水蒸气,体积增大,反应物浓度减小,速率速率降低,故A错误; B.正反应吸热,温度升至1500K ,速率加快,平衡正向移动,故B正确; C.在容积和温度不变下充入Ar,反应物浓度不变,所以速率不变,平衡不移动,故C错误; D.选用催化效果更好的催化剂,平衡不移动,故D错误。(3)①放电时,正极CO2得电子发生还原反应,电极反应式是3CO2+4Na++4e-=2Na2CO3+C;②根据总反应,转移0.2mol 电子时,负极消耗0.2molNa,正极生成0.1nol Na2CO3和0.05molC,所以两极的质量差为
;Ⅲ A.恒容时加入稀释剂水蒸气,体积增大,反应物浓度减小,速率速率降低,故A错误; B.正反应吸热,温度升至1500K ,速率加快,平衡正向移动,故B正确; C.在容积和温度不变下充入Ar,反应物浓度不变,所以速率不变,平衡不移动,故C错误; D.选用催化效果更好的催化剂,平衡不移动,故D错误。(3)①放电时,正极CO2得电子发生还原反应,电极反应式是3CO2+4Na++4e-=2Na2CO3+C;②根据总反应,转移0.2mol 电子时,负极消耗0.2molNa,正极生成0.1nol Na2CO3和0.05molC,所以两极的质量差为![]() 15.8g。
15.8g。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.CO2的转化一直是全球研究的热点,其中将CO2和H2合成甲醇及二甲醚 (CH3OCH3)具备相对成熟的技术。工业生产中,有以下相关反应
①CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l) △H < 0
CH3OH(l) + H2O(l) △H < 0
②2 CH3OH(l) ![]() CH3OCH3(g) + H2O(l) △H < 0
CH3OCH3(g) + H2O(l) △H < 0
③CO(g) + H2O(l) ![]() CO2(g) + H2(g) △H < 0
CO2(g) + H2(g) △H < 0
(1)在一常温恒容的密闭容器中,放入一定量的甲醇如②式建立平衡,以下说法正确并可以作为该反应达到平衡状态的判断依据为________。
A.容器内气体相对分子质量保持不变
B.容器内气体压强不变
C.相同时间内消耗甲醇的量是消耗二甲醚的两倍;
D.甲醇和二甲醚物质的量相等
(2)在三个体积相同的密闭容器A,B,C中加入相同物质的量的CO和H2O在不同温度下发生反应③,经过相同时间后测得容器中的CO物质的量与温度的关系如下图:

① A、B两点的速率大小v(A)___v(B)(填“大于”、“小于”、“等于”、“无法判断”)
② 请解释曲线中CO的物质的量先减小后增大的原因________________________。
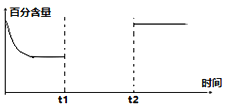
(3)一定量的CO2和H2在一密闭容器中发生反应①,下左图是容器内CO2的百分含量随着外界条件改变的变化曲线图,请补充完整。(t1时刻升温;t2时刻加催化剂)______

Ⅱ.SO2的尾气处理通常用电化学处理法
(4)①如上右图所示,Pt(Ⅱ)电极的反应式为__________________;
②当电路中转移0.02mole-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加_____mol离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过二硫酸钾(K2S2O8) 在科研与工业上有重要用途。
(1)S2O82-的结构式为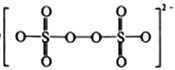 ,其中S元素的化合价为_________________。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是___________(填离子符号)。
,其中S元素的化合价为_________________。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是___________(填离子符号)。
(2)某厂采用湿法K2S2O8氧化脱硝和氨法脱硫工艺综合处理锅炉烟气,提高了烟气处理效率,处理液还可以用作城市植被绿化的肥料。
①脱硫过程中,当氨吸收液的pH=6时,n(SO32-)∶n(HSO3-) =________。
[巳知:25℃时,Ka1(H2SO3)=1.5×10-2,K a2(H2SO3)=1.0×10-7]
②脱硝过程中依次发生两步反应:第1步,K2S2O8将NO氧化成HNO2,第2步,K2S2O8继续氧化HNO2,第2步反应的化学方程式为______________________________________;
一定条件下,NO去除率随温度变化的关系如右图所示。80℃时,若NO初始浓度为450mg·m-3,t min达到最大去除率,NO去除的平均反应速率:
v(NO) =____mol·L-1·min-1(列代数式)
(3)过二硫酸钾可通过“电解→转化→提纯”方法制得,电解装置示意图如右图所示。
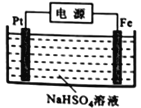
①电解时,铁电极连接电源的_________________极。
②常温下,电解液中含硫微粒的主要存在形式与pH的关系如下图所示。
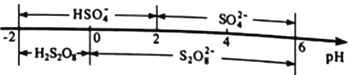
在阳极放电的离子主要是HSO4-,阳极区电解质溶液的pH范围为_________,阳极的电极反应式为________________________。
③往电解产品中加入硫酸钾,使其转化为过二硫酸钾粗产品,提纯粗产品的方法_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几种物质:A.石墨和金刚石 B. 35Cl和37Cl C.CH3CH=CHCH3和(CH3)2C=CH2 D.丁烷和新戊烷E. 
(1)属于同素异形体的是__________________
(2)属于同位素的是__________________
(3)属于同分异构体的是__________________
(4)属于同系物的是__________________
(5)属于同种物质的是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是混合物分离的实验,请回答有关问题
实验:通过蒸馏的方法除去自来水中含有的氯离子等杂质制取纯净水,如图所示
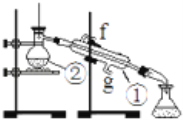
(1)写出下列仪器的名称:①________②________。
(2)若利用以上装置分离酒精和四氯化碳两种溶液的混合物,还缺少的仪器是________,图中装置中进水口是________。(填“f”或“g”)
(3)仪器①中常加入碎瓷片,这样做的目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA 代表阿伏加德罗常数的数值,下列说法正确的是 ( )
A. 18gH2O在标准状况下的体积是22.4L
B. 常温常压下28g以任意比组成的CO与N2混合气体中含有2NA 个原子
C. 5.6g Fe与足量盐酸反应,转移的电子数为0.3NA
D. 将0.1mol氯化钠溶于1L水中,所得溶液浓度为0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1molAlN需转移3mol电子
C. AlN中氮元素的化合价为+3
D. CO是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法是还原沉淀法。该法的工艺流程为:
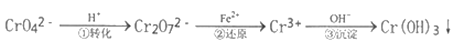
已知:CrO42-(黄色)、Cr2O72- (橙色)
(1)用离子方程式表示第①步可逆反应转化过程___________________。
(2)用离子方程式表示第②步还原反应转化过程___________________。
(3)能说明第①步反应达平衡状态的是_________。
a.Cr2O72-和CrO42-的浓度不变 b.2V(Cr2O72-) =V(CrO42-) c.溶液的颜色不变
(4)第②步中,还原1.5mol Cr2O72-离子,需要_______mol的FeSO47H2O。
(5)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr (OH)3 (s)![]() Cr3+ (aq) +3OH- (aq)。常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-) = 10-32,要使0.01mol/Lc(Cr3+)开始沉淀,溶液的pH应调至__________,若使c(Cr3+)降至10-5mol/L,溶液的pH应调至___________。
Cr3+ (aq) +3OH- (aq)。常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-) = 10-32,要使0.01mol/Lc(Cr3+)开始沉淀,溶液的pH应调至__________,若使c(Cr3+)降至10-5mol/L,溶液的pH应调至___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com