
【题目】有硫酸镁溶液500 mL,它的密度是1.20 g·cm-3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是
A.溶质的质量分数是24.0%B.硫酸镁的物质的量浓度是2.4 mol·L-1
C.溶质和溶剂的物质的量之比是1:40D.硫酸根离子与硫酸镁的物质的量浓度相同
【答案】C
【解析】
A、该硫酸镁溶液的质量为1.20gcm-3×500mL=600g,镁离子在硫酸镁分子中的含量为![]() ×100%=20%,其中镁离子的质量为600g×4.8%=28.8g,所以溶液中硫酸镁的质量为
×100%=20%,其中镁离子的质量为600g×4.8%=28.8g,所以溶液中硫酸镁的质量为![]() =144g,该硫酸镁溶液的质量分数为
=144g,该硫酸镁溶液的质量分数为![]() ×100%=24.0%,故A正确;
×100%=24.0%,故A正确;
B、溶液中硫酸镁的质量为144g,其物质的量为![]() =1.2mol,根据c=
=1.2mol,根据c=![]() ,溶液的物质的量浓度为
,溶液的物质的量浓度为![]() =2.4mol·L-1,故B正确;
=2.4mol·L-1,故B正确;
C、溶液中的溶剂水的质量为:600g×(1-24%)=456g,水的分子量为18,所以该硫酸镁溶液中水的物质的量为![]() =25.33mol,溶液中硫酸镁的质量为144g,其物质的量为1.2mol,所以溶质与溶剂物质的量之比为1.2:25.33=1:21.11,故C错误;
=25.33mol,溶液中硫酸镁的质量为144g,其物质的量为1.2mol,所以溶质与溶剂物质的量之比为1.2:25.33=1:21.11,故C错误;
D、MgSO4=Mg2++ SO42-,所以硫酸根离子的物质的量等于硫酸镁物质的量,因此硫酸根离子与硫酸镁的物质的量浓度相同,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】阿比朵尔是抗击新型冠状病毒的潜在用药,其结构简式如图示,下列有关说法正确的是
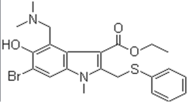
A.含氧官能团的名称:羟基、羧基
B.分子式:C22H25BrN2O3S
C.能使酸性高锰酸钾溶液、溴水褪色,且褪色原理相同
D.1mol该物质最多与6molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
已知:N2H4·H2O高温易分解,易氧化
制备原理:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
(实验一) 制备NaClO溶液(实验装置如图所示)
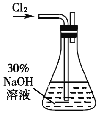
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有_____(填标号)
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应化学程式是_____________________________。
(实验二) 制取水合肼。(实验装置如图所示)
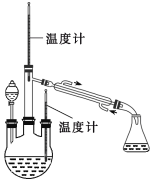
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114馏分。
(3)分液漏斗中的溶液是____________(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO混合溶液
选择的理由是____________。蒸馏时需要减压,原因是______________。
(实验三) 测定馏分中肼含量。
(4)水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体(保证滴定过程中溶液的pH保持在6.5左右),配制1000mL溶液。
b.移取10.00 mL于锥形瓶中,加入10mL水,摇匀。
c.用0.2000mol/L碘溶液滴定至溶液出现______________,记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(5)滴定时,碘的标准溶液盛放在______________滴定管中(选填:“酸式”或“碱式”)水合肼与碘溶液反应的化学方程式________________________。
(6)若本次滴定消耗碘的标准溶液为8.20mL,馏分中水合肼(N2H4·H2O)的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化。为了验证该结论,学生设计了如下图所示的实验装置进行实验(夹持装置略去)。请回答下列问题。
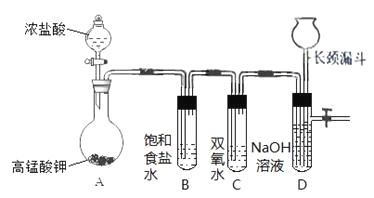
(1)A中的方程式为_____________________(用单线桥标电子转移方向与数目);
(2)试管B中饱和食盐水的作用__________________;
(3)试管C中加入5mL 30% 双氧水,发生反应的化学方程式____________________;
(4)试管D中充满10% NaOH溶液,NaOH溶液的作用是__________________;
(5)将浓盐酸注入圆底烧瓶A,当装置中的空气基本排尽后关闭止水夹,反应一段时间后试管D中的现象为_____________________________________________,试管D中的气体检验方法为____________;
(6)有的同学对上述实验中D试管中的气体来源产生质疑,你认为可能的来源有:_____________(用方程式回答)。对于质疑可以采用对比实验来解决。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4LHF的分子数约为NA
B.将1molCl2通入水中,HClO、Cl-、ClO-的粒子数之和为2NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,线路中通过电子数目为2NA
D.若用惰性电极电解足量CuSO4溶液后,加入0.1molCuO可以复原,则电解时转移电子数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Fe(OH)3胶体的制备方法为:将_____________逐滴滴入_______中,继续加热煮沸,直至分散系呈现______。判断是否有胶体生成的方法是利用_______效应。
(2)硫化氢气体通入浓硫酸中发生反应:H2S + H2SO4(浓) === S↓ + SO2↑ + 2H2O
用单线桥法表示电子转移的方向和数目________________________,该反应的还原产物是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家已研制出一种可替代锂电池的“可充室温Na-CO2电池”,该电池结构如图所示。电极材料为钠金属片和碳纳米管,电解液为高氯酸钠-四甘醇二甲醚。下列说法错误的是( )
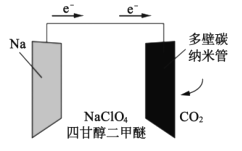
A.电池放电时钠金属片发生氧化反应
B.电池工作时,外电路流过0.01mol电子,负极材料减重0.23g
C.碳纳米管的作用主要是导电及吸附CO2,电池充电时,应该与直流电源的正极相连
D.放电时负极反应为:C+2Na2CO3-4e-=3CO2↑+4Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酮洛芬是临床用于治疗疼痛的药物。合成酮洛芬的一种路线如下:

(1)F中含氧官能团的名称为____________________(写两种)。
(2) 与(CH3)2SO4反应也可以直接得到酮洛芬,该反应的类型为____________。
与(CH3)2SO4反应也可以直接得到酮洛芬,该反应的类型为____________。
(3)B的分子式为C10H11NO4,写出B的结构简式:____________________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:______________________。
①能与FeCl3溶液发生显色反应,且分子中有一个手性碳原子;
②碱性条件水解后酸化,产物之一是α-氨基酸,另一水解产物分子中只有3种不同化学环境的氢。
(5)已知:NO2![]() NH2。
NH2。
请写出以 和ClCH2COOC2H5为原料制备H3COCH3CHO的合成路线流程图___________(无机试剂任用,合成路线流程图示例见本题题干)。
和ClCH2COOC2H5为原料制备H3COCH3CHO的合成路线流程图___________(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com