
【题目】阿比朵尔是抗击新型冠状病毒的潜在用药,其结构简式如图示,下列有关说法正确的是
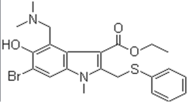
A.含氧官能团的名称:羟基、羧基
B.分子式:C22H25BrN2O3S
C.能使酸性高锰酸钾溶液、溴水褪色,且褪色原理相同
D.1mol该物质最多与6molH2发生加成反应
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】苯甲醇是一种重要的化工原料,广泛用于香料、造纸、制药和印染等行业。实验室制备苯甲醇的反应原理和有关数据如图:
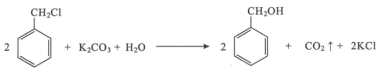
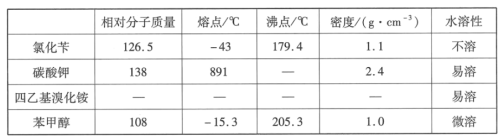
实验步骤:如图所示,在装有电动搅拌器的250mL三颈烧瓶里加入9.0g碳酸钾(过量),70.0mL水,加热溶解,再加入2.0mL四乙基溴化铵[(CH3CH2)4NBr]溶液和10.0mL氯化苄。搅拌加热回流反应1~1.5h。反应结束后冷却,并转入125mL分液漏斗中,分出有机层,水层用萃取剂萃取三次。合并萃取液和有机层,加入无水硫酸镁固体,静置、过滤。最后进行蒸馏纯化,收集200~208℃的馏分,得8.4mL苯甲醇。
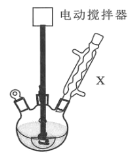
回答下列问题:
(1)仪器X的名称是___,冷却水应从___(填“上口”或“下口”)通入。由于苯甲醇的沸点较高,在蒸馏纯化操作中最适宜选用的仪器之一是___(填字母)。
(2)本实验中加入无水硫酸镁的目的是___。从绿色化学角度考虑,萃取剂宜采用___(填字母)。
A.乙醇 B.乙酸乙酯 C.苯 D.氯仿
(3)某同学认为该装置中的电动搅拌器可以换成沸石,以防暴沸。该说法___(填“是”或“否”)正确,其理由是___。
(4)四乙基溴化铵没有直接参与反应,但大大提高了反应速率,其原因可能是___。
(5)本实验苯甲醇的产率为___%(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)是有机合成中常用的还原剂。一种制备硼氢化钠工艺如下(部分条件和产物省略):
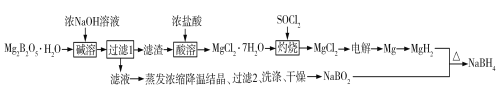
已知:MgH2、NaBH4遇水蒸气剧烈反应并放出H2。
回答下列问题:
(1)Mg2B2O5H2O中B的化合价为_______________。MgH2和NaBO2必须在干燥条件下合成硼氢化钠,其原因是_____________________________________________。
(2)难溶的Mg2B2O5与浓氢氧化钠溶液反应的离子方程式为__________。
(3)SOCl2溶于水能产生两种气体,其中一种气体能使品红溶液褪色,则灼烧时加入SOCl2的目的是______________________________。
(4)已知镁—H2O2酸性燃料电池反应为Mg+H2O2+H2SO4![]() MgSO4+2H2O。常温下,电解质溶液为200 mL 0.1 mol·L1硫酸溶液。
MgSO4+2H2O。常温下,电解质溶液为200 mL 0.1 mol·L1硫酸溶液。
①写出正极的电极反应式:______________________________。
②若电路中有0.038 mol转移电子时,则溶液pH约为_____(忽略体积变化,不考虑H2O2电离)。
(5)“有效氢”是衡量含氢还原剂的还原能力指标,定义为1 g含氢还原剂的还原能力与多少克H2相当。NaBH4的“有效氢”等于_________________(结果保留2位小数)。
(6)工业上,可以利用NaBO2、HCHO和生石灰在加热下生成NaBH4和难溶的盐,写出化学方程式________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的离子方程式
(1)二氧化碳通入澄清石灰水_________________________________
(2)小苏打除胃酸___________________________________________
(3)硫酸和氢氧化钠反应_____________________________________
(4)金属铜和硝酸银溶液反应_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 能自发进行的反应一定能迅速发生
B. 非自发进行的反应一定不可能发生
C. 能自发进行的反应实际可能没有发生
D. 常温下发生反应2H2O![]() 2H2↑ + O2↑,说明常温下水的分解反应是自发反应
2H2↑ + O2↑,说明常温下水的分解反应是自发反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的化合物应用非常广泛,刻制印刷电路板时要用FeCl3溶液为腐蚀液,其反应的化学方程式为:2FeCl3+Cu =2FeCl2+CuCl2
⑴该反应的氧化剂是_______________________(填化学式)。
⑵请用双线桥法标出该反应电子的转移的方向和数目。2FeCl3+Cu =2FeCl2+CuCl2_____________________
⑶使用过的腐蚀液会失效,但还可以回收利用,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是_____________________________(填序号)。
①氯气 ②铁 ③盐酸 ④稀硫酸
⑷某久置的FeCl2溶液略显黄色,某同学认为可能有部分Fe2+被氧化为Fe3+,因此配制FeCl2溶液时需加少量铁粉,请写出Fe3+转化为Fe2+的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,醋酸溶液中存在下述关系:Ka=c(H+)c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中Ka的数值是该温度下醋酸的电离平衡常数。有关Ka的下列说法正确的是( )
A. 当向该溶液中加入一定量的硫酸时,Ka的值增大
B. 升高温度,Ka的值增大
C. 向醋酸溶液中加水,Ka的值增大
D. 向醋酸溶液中加氢氧化钠溶液,Ka的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
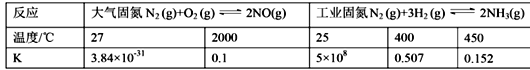
①分析数据可知:大气固氮反应属于 _______(填“吸热”或“放热”)反应。
②从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因 _____________________________________________。
③在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通容器中发生如下反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0。反应达到平衡后,测得混合气体为7体积。达到平衡时N2的转化率_______________________。
2NH3(g) △H<0。反应达到平衡后,测得混合气体为7体积。达到平衡时N2的转化率_______________________。
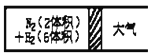
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,下图所示的图示中,正确的是_______(填“A”或“B”);比较p1、p2的大小关系: p1_______________p2(填“>”或“<”)。
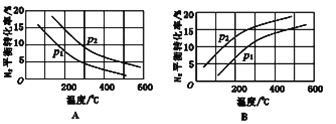
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有硫酸镁溶液500 mL,它的密度是1.20 g·cm-3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是
A.溶质的质量分数是24.0%B.硫酸镁的物质的量浓度是2.4 mol·L-1
C.溶质和溶剂的物质的量之比是1:40D.硫酸根离子与硫酸镁的物质的量浓度相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com