
【题目】下列说法中正确的是( )
A. 能自发进行的反应一定能迅速发生
B. 非自发进行的反应一定不可能发生
C. 能自发进行的反应实际可能没有发生
D. 常温下发生反应2H2O![]() 2H2↑ + O2↑,说明常温下水的分解反应是自发反应
2H2↑ + O2↑,说明常温下水的分解反应是自发反应
科目:高中化学 来源: 题型:
【题目】镍及其化合物是重要的合金材料和催化剂。
(1)基态镍原子的价电子排布式为___,它核外有___种运动状态不同的电子。
(2)Ni2+可以形成多种配离子,比如[Ni(NH3)4]2+、[Ni(CN)4]2-等。CN-中碳原子的杂化方式为___,与CN-互为等电子体的一种分子是___。[Ni(NH3)4]2+中H-N-H键角比NH3分子中H-N-H键角___(填“大”、“小”或“相等”),原因是___。
(3)元素铜与镍的第二电离能分别为:I2(Cu)=1958kJ/mol、I2(Ni)=1753kJ/mol,铜的第二电离能更大的原因是___。
(4)NiO的晶体结构如图甲所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为___。
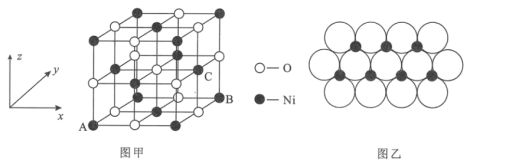
(5)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为apm,设阿伏加德罗常数的值为NA,每平方米面积上分散的该晶体的质量为___g(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)相对分子质量为72且沸点最低的烷烃的结构简式为________。
(2)键线式![]() 表示的分子式为_________;1 mol该烃完全燃烧需消耗氧气的物质的量为_____mol。
表示的分子式为_________;1 mol该烃完全燃烧需消耗氧气的物质的量为_____mol。
(3)松油醇![]() 含有的官能团的名称为__________________.
含有的官能团的名称为__________________.
(4)分子式为C4H4且含两种官能团的链状有机物的结构简式为____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图某工厂用NO气体制取NH4NO3溶液,下列说法正确的是
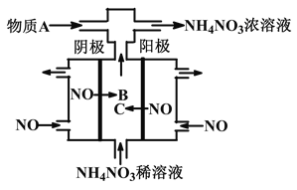
A. 阳极的电极反应式为:NO-3e-+2H2O=NO2-+4H+
B. 物质B与物质C是同一种物质
C. A物质可为氨气
D. 阴、阳两极转移的电子数之比为5∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中NO产生的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:

A. 温度T下,该反应的平衡常数K=![]()
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿比朵尔是抗击新型冠状病毒的潜在用药,其结构简式如图示,下列有关说法正确的是
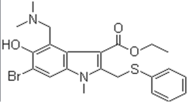
A.含氧官能团的名称:羟基、羧基
B.分子式:C22H25BrN2O3S
C.能使酸性高锰酸钾溶液、溴水褪色,且褪色原理相同
D.1mol该物质最多与6molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2催化加氢制甲醇,是极具前景的温室气体资源化研究领域。在某CO催化加氢制甲醇的反应体系中,发生的主要反应有:
i.CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.4kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.4kJ·mol-1
ⅱ.CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2=+41.2kJ·mol-1
CO(g)+H2O(g) △H2=+41.2kJ·mol-1
ⅲ.CO(g)+2H2(g) ![]() CH3OH(g) △H3
CH3OH(g) △H3
(1)△H3________ kJ·mol-1
(2)5MPa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
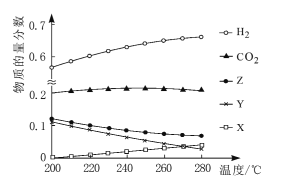
①体系中CO2的物质的量分数受温度的影响不大,原因是____。
②250℃时,反应ii的平衡常数____1(填“>”“<”或“=”)。
③下列措施中,无法提高甲醇产率的是____(填标号)。
A 加入适量CO B 增大压强 C 循环利用原料气 D 升高温度
④如图中X、Y分别代表____(填化学式)。
(3)反应i可能的反应历程如下图所示。
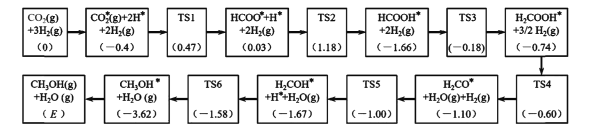
注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位:eV)。其中,TS表示过渡态、*表示吸附在催化剂上的微粒。
①反应历程中,生成甲醇的决速步骤的反应方程式为____。
②相对总能量E=____(计算结果保留2位小数)。(已知:leV=1.6×10-22kJ)
(4)用电解法也可实现CO2加氢制甲醇(稀硫酸作电解质溶液)。电解时,往电解池的____极通入氢气,阴极上的电极反应为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将11.2g铁粉投入200mL的稀硫酸中,充分反应后,铁粉完全溶解。(假设反应后溶液体积不发生变化,写出计算过程)
⑴求标准状况下产生气体的体积。(已知:Fe+H2SO4=FeSO4+H2↑)_____________
⑵求反应后溶液中FeSO4的物质的量浓度。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4LHF的分子数约为NA
B.将1molCl2通入水中,HClO、Cl-、ClO-的粒子数之和为2NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,线路中通过电子数目为2NA
D.若用惰性电极电解足量CuSO4溶液后,加入0.1molCuO可以复原,则电解时转移电子数目为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com