
【题目】今有一混合物水溶液,可能含有以下离子中的若干种:Na+、Ba2+、Cl﹣、CO32﹣、SO42﹣,现取200mL溶液加入BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。根据上述实验,以下推断不正确的是
A.溶液中一定存在CO32﹣、SO42﹣、Na+B.溶液中c(Na+)≥0.6mol·L-1
C.溶液中一定没有Ba2+,可能存在Cl﹣D.溶液中n(SO42﹣)>0.02mol
【答案】D
【解析】
200mL溶液加入BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。此信息告诉我们,m(BaSO4)= 4.66g,m(BaCO3)= 12.54g-4.66g=7.88g。
从分析中我们可以得出:n(BaSO4)=![]() ,
,
n(BaCO3)=![]() ,从而得出n(SO42-)=0.02mol,n(CO32-)=0.04mol。
,从而得出n(SO42-)=0.02mol,n(CO32-)=0.04mol。
依据离子共存原则,溶液中一定不含有Ba2+;依据电荷守恒原则,溶液中一定含有Na+,
但不能肯定Cl-是否存在。从而得出n(Na+)≥2n(SO42-)+2n(CO32-)=0.12mol,
cNa+)≥![]() ,
,
A. 溶液中一定存在CO32﹣、SO42﹣、Na+,正确;
B. 溶液中c(Na+)≥0.6mol·L-1,正确;
C. 溶液中一定没有Ba2+,可能存在Cl-,正确;
D. 溶液中n(SO42﹣)>0.02mol,错误。
故选D。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,下列叙述中正确的是
A.常温常压下,48gO2与O3的混合物中含有的氧原子数为3NA
B.0.1 mol·L-1 NaCl溶液中Na+子数为NA
C.4℃时9mL水和标准状况下11.2L氮气含有相同的原子数
D.同温同压下,NA个NO与NA个N2和O2的混合气体的体积不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期律与周期表是学习元素化合物知识的重要工具。C与Si,N与P分别位于同一主族。其气态氢化物的分解温度如下表:
物质 | CH4 | SiH4 | NH3 | PH3 |
分解温度/K | 873 | 773 | 1073 | T |
(1)CH4分解温度高于SiH4的原因是_________。
(2)仅依据元素非金属性强弱关系,预测PH3分解温度(T)的范围________;
(3)某同学为证明非金属性![]() ,设计如图装置:
,设计如图装置:
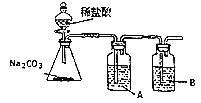
①A处盛放的试剂是__________;
②B中出现的现象是______;B处发生的离子反应方程式为_____________;
③该同学的设计中存在的问题是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有48.4g碱式碳酸镁样品(化学式:xMgCO3·yMg(OH)2·zH2O,x、y、z为正整数),将其分为二等份,一份样品充分灼烧至恒重进行热重分析,结果如图所示。另一份投入150mL某溶液的盐酸中,充分反应后生成CO24.48L(已知算成标准状况下),所得溶液稀释至250mL,测得溶液的c(H+)=0.100mol/L。

按要求回答下列问题:
(1)盐酸的物质的量浓度c(HCl)=______mol/L
(2)x:y:z=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以孔雀石[主要成分是CuCO3·Cu(OH)2,还含有少量杂质FeO、Fe2O3、SiO2]为原料制备CuSO4·5H2O步骤如下:
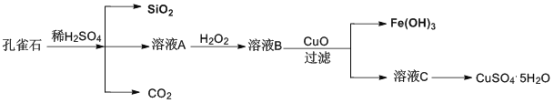
请回答下列问题:
(1)溶液A的金属离子有Fe3+和___。检验溶液A中含有Fe3的试剂是___。
(2)溶液A中加入H2O2的目的是___,发生的离子方程式为___。
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、___、过滤等操作。
(4)溶液B与CuO反应生成Fe(OH)3和溶液C的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,W、Z核外电子数之和是X核外电子数的2倍,Y的最外层电子数是其质子数的![]() 。下列叙述正确的是
。下列叙述正确的是
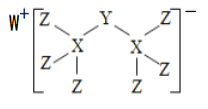
A. Y元素对应的最高价氧化物的水化物是强酸
B. 原子半径:X>Y>Z
C. 该新化合物中的Y元素不满足8电子稳定结构
D. Y、Z两元素可形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取表面部分氧化的镁条8.00g溶于250mL4.00mol·L-1的稀盐酸中,向所得溶液中滴加未知浓度的NaOH溶液,产生沉淀的质量与NaOH溶液的体积关系如图所示:
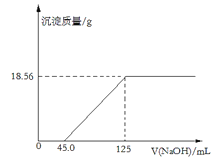
请计算:
(1)NaOH溶液的物质的量浓度___mol·L-1。
(2)样品中镁元素的质量___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由两种有机物组成的混合物,在一定的温度和压强下完全气化为气体.在相同的温度和压强下,只要混合气体体积一定,那么无论两物质以何种比例混合,其完全燃烧时所消耗的氧气体积就是一定的,符合这种情况的可能组合是:
A. 乙醇(![]() )和乙酸(
)和乙酸(![]() ) B. 乙醛(
) B. 乙醛(![]() )和甲醇(
)和甲醇(![]() )
)
C. 丙醛(![]() )和甘油(
)和甘油(![]() ) D. 丙酮(
) D. 丙酮(![]() )和丙二醇(
)和丙二醇(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知溴乙烷(C2H5Br)是无色液体,沸点38.4℃,密度比水大,难溶于水,可溶于多种有机溶剂。在溴乙烷与NaOH乙醇溶液的消去反应中可以观察到有气体生成。有人设计了如图所示的装置,用KMnO4酸性溶液是否褪色来检验生成的气体是否是乙烯。

请回答下列问题:
(1)仪器a的名称为__________。
(2)实验前应检测装置A的气密性。方法如下:关闭止水夹c,由仪器a向仪器b中加水,若______________________________,则证明装置A不漏气。
(3)仪器b中发生反应的化学方程式为______________________________。
(4)反应开始一段时间后,在装置B底部析出了较多的油状液体,若想减少油状液体的析出,可对装置A作何改进?__________________________________________________
(5)装置A中产生的气体通入装置C之前要先通过装置B,装置B的作用为__________________。
(6)检验乙烯除用KMnO4酸性溶液外还可选用的试剂有__________,此时,是否还有必要将气体先通过装置B?__________(填“是”或“否”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com