
 CO��g����3H2��g�� ��H1 ��CO��g����2H2��g��
CO��g����3H2��g�� ��H1 ��CO��g����2H2��g�� CH3OH��g����H2 ��0��2mol CH4��0��3mol H2O��g��ͨ���ݻ�Ϊ10L���ܱ������У���һ�������·�����Ӧ�٣��ﵽƽ��ʱ��CH4��ת�������¶ȣ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
CH3OH��g����H2 ��0��2mol CH4��0��3mol H2O��g��ͨ���ݻ�Ϊ10L���ܱ������У���һ�������·�����Ӧ�٣��ﵽƽ��ʱ��CH4��ת�������¶ȣ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��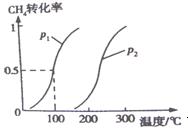
 ʽΪK= ��100�棬ѹǿΪp1ʱƽ�ⳣ����ֵ�� ��
ʽΪK= ��100�棬ѹǿΪp1ʱƽ�ⳣ����ֵ�� ��| ʵ���� | T�� | n��CO��/n��H2�� | p ��Mpa�� |
| I | 150 | 1/3 | 0��1 |
| �� | | | 5 |
| �� | 350 | | 5 |

 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д� ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������Һ�еμ���������ͭ��Һ | B���ʵ����������Ũ�� |
| C���Է�Ӧ��Һ���м��� | D���������ѹǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3������˵���������
2NH3������˵���������| A��ʹ�ú��ʵĴ������Լӿ췴Ӧ���� |
| B�������¶ȿ��Լӿ췴Ӧ���� |
| C������N2Ũ�ȿ���ʹH2ת���ʴﵽ100% |
| D������N2Ũ�ȿ��Լӿ췴Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NO2����H ��0����ÿ��һ��ʱ��������ڵ����ʽ��вⶨ���õ��������ݣ�
2NO2����H ��0����ÿ��һ��ʱ��������ڵ����ʽ��вⶨ���õ��������ݣ�| ʱ�䣨s�� | 0 | 20 | 40 | 60 | 80 | 100 |
| n��N2O4����mol�� | 0.40 | a | 0.20 | c | d | e |
| n��NO2����mol�� | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
 ���N2O4��ת���ʽ� �����������С�����䡱����
���N2O4��ת���ʽ� �����������С�����䡱�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.24 mol/(L��min) | B��0.08mol/(L��min) |
| C��0.06 mol/(L��min) | D��0.12mol/(L��min) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g)
CH3OH(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ������ձ��У�������ˮϡ����500mL����ʱx�����Ỻ�͵ؽ��з�Ӧ�����з�Ӧ����������
������ձ��У�������ˮϡ����500mL����ʱx�����Ỻ�͵ؽ��з�Ӧ�����з�Ӧ����������A��20 mL�� | B��20 mL�� |
C��10 mL�� | D��10 mL�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 3C(g)��4D(g)�У���������ܹ����÷�Ӧ���ʵ���
3C(g)��4D(g)�У���������ܹ����÷�Ӧ���ʵ���| A�������¶� | B����Сѹǿ | C��ʹ�ô��� | D������A��Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 H2(g)��I2(g)�ﵽƽ�⣬����˵���п϶���ȷ���ǣ� ��
H2(g)��I2(g)�ﵽƽ�⣬����˵���п϶���ȷ���ǣ� ���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com