
【题目】NOx是大气污染的主要污染物之一。
(1)NOx能形成酸雨,写出NO2完全转化为HNO3的总反应的化学方程式:_______________________
(2)硝酸厂常用如下两种方法处理NOx尾气。
①催化还原法:在催化剂存在时用H2将NO2还原为N2,写出该反应的化学方程式:_________________
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2,若9.2gNO2和Na2CO3溶液完全反应时转移0.1 mol电子,则反应的离子方程式为______________________________
(3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NO在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:_______________________________
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。第II A族金属氧化物吸收能力顺序如下:12 MgO<20CaO<38SrO<56BaO。原因是___________________________________。
【答案】4NO2+O2+2H2O==4HNO3 4H2+ 2NO2 ![]() N2 +4H2O 2NO2 +CO
N2 +4H2O 2NO2 +CO![]() =CO2 +NO
=CO2 +NO![]() +NO
+NO![]() 2NO+ 2CO
2NO+ 2CO![]() N2 +2CO2 Mg、Ca、Sr、Ba电子层数增多,原子半径增大
N2 +2CO2 Mg、Ca、Sr、Ba电子层数增多,原子半径增大
【解析】
(1) NO2和水反应3NO2+H2O=2HNO3+NO,再通入氧气2NO+O2= 2NO2,多次循环后能完全转化为HNO3,反应一乘以二再加上反应二,得到总反应的化学方程式为:4NO2+O2+2H2O==4HNO3;
(2)①在催化剂存在时用H2将NO2还原为N2同时生成水,该反应的化学方程式为:4H2+ 2NO2![]() N2+4H2O;
N2+4H2O;
②n(NO2)=![]() =0.2mol,该反应中NO2被氧化生成NO
=0.2mol,该反应中NO2被氧化生成NO![]() ,0.2molNO2反应转移0.1mol电子,则生成n(NO
,0.2molNO2反应转移0.1mol电子,则生成n(NO![]() )=
)=![]() =0.1mol,则剩余0.1mol二氧化氮被还原生成其它物质,且转移0.1mol电子,则生成物中N元素化合价为+3价,且生成物在水溶液中,应该是亚硝酸根离子,则反应的离子方程式为:2NO2+CO
=0.1mol,则剩余0.1mol二氧化氮被还原生成其它物质,且转移0.1mol电子,则生成物中N元素化合价为+3价,且生成物在水溶液中,应该是亚硝酸根离子,则反应的离子方程式为:2NO2+CO![]() =CO2+NO
=CO2+NO![]() +NO
+NO![]() ;
;
(3)①当尾气中空气不足时,NO在催化转化器中被CO还原成N2排出,化学方程式为:2NO+ 2CO![]() N2+2CO2;
N2+2CO2;
②Mg、Ca、Sr、Ba均为IIA族元素.同一主族的元素,从上到下,原子半径逐渐增大,原子半径越大,反应接触面积越大,则吸收能力越大,所以原因是Mg、Ca、Sr、Ba电子层数增多,原子半径增大。


科目:高中化学 来源: 题型:
【题目】ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
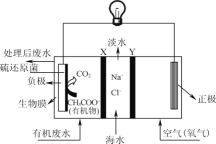
A.该装置工作时,电能转化为化学能
B.负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
C.该装置可以在高温下工作
D.X为阳离子交换膜,Y为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别燃烧等物质的量的下列各组物质,其中消耗氧气量相等的是
①C2H2与 CH3CHO ②C7H8与C6H12 ③C2H2与C6H6 ④HCOOCH3与CH3COOH,
A. ①②③④B. ①④C. ①②④D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有下列几种物质:
A:石墨和C60
B:35Cl和37Cl
C:CH3CH=CHCH3和(CH3)2C=CH2
D.
E.间二甲苯和异丙苯
请把合适字母填入以下横线里:
①属于同分异构体的是______________________
②属于同系物的是__________________________
③属于同种物质的是________________________
(2)下图是某药物中间体的结构示意图
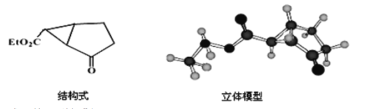
试回答下列问题:
①观察上面的结构简式图1与立体模型图2,通过对比指出结构简式中的“Et”表示_______________________(填名称),该药物中间体分子的化学式为___________,
②现有一种芳香化合物与该药物中间体互为同分异构体,其模拟的核磁共振氢谱图如上图所示,试写出该化合物的结构简式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C3H6)是基本有机化工原料,由A制备聚合物C和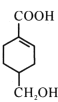 合成路线如图所示(部分条件略去)。
合成路线如图所示(部分条件略去)。
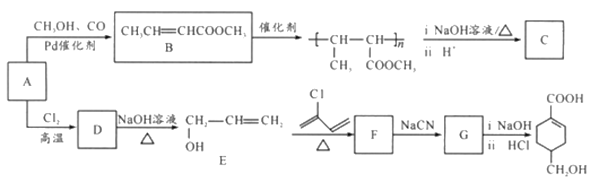
已知: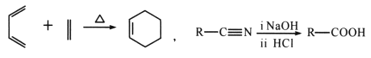
(1) 发生缩聚形成的高聚物的结构简式为__________;D-E的反应类型为__________。
发生缩聚形成的高聚物的结构简式为__________;D-E的反应类型为__________。
(2)E-F的化学方程式为____________________。
(3)B的同分异构体中,与B具有相同官能团且能发生银镜反应,其中核磁共振氢谱上显示3组峰,且峰面积之比为6:1:1的是________________(写出结构简式)。
(4)等物质的量的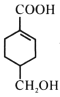 分别与足量NaOH、Na2CO3、NaHCO3反应, 消耗NaOH、Na2CO3 、NaHCO3的物质的量之比为________________;检验
分别与足量NaOH、Na2CO3、NaHCO3反应, 消耗NaOH、Na2CO3 、NaHCO3的物质的量之比为________________;检验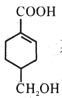 的碳碳双键的方法是________________(写出对应试剂及现象)。
的碳碳双键的方法是________________(写出对应试剂及现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取的乙烯常含有少量二氧化硫,现设计如下实验,确认混合气体中有乙烯和二氧化硫。
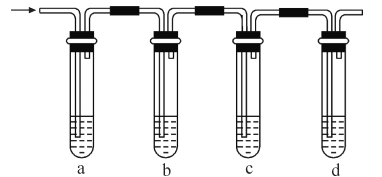
(1)a、b、c、d装置可盛放的试剂是:a_______,b________,c_______,d_______
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性高锰酸钾溶液
(2)b装置的作用是________________________________
(3)确定混合气体中含有乙烯的现象是_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示转化关系中A、B、C均为双原子气态单质,分别由短周期主族元素X、Y、Z组成。其中单质B含共用电子对数最多,甲和丙分子中均含有10个电子。下列说法正确的是( )
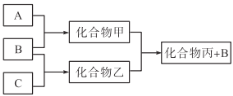
A.化合物乙是一种酸性氧化物B.丙沸点比甲高,是因为丙的相对分子质量更大
C.原子半径大小关系X<Y<ZD.X、Y、Z三种元素形成的化合物不一定是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可以形成多种化合物,如NH3、N2H4、NO、HNO3等。
(1)汽车尾气中含NO和CO,为减轻污染,某市为汽车加装了“三效催化净化器”,可将尾气中的CO、NO转化为可参与大气循环的无毒混合气体,反应的化学方程式为___________________________________。
(2)工业上以惰性材料为电极采用电解法处理汽车尾气中的NO,将NO转化成NH4NO3,用硝酸铵溶液作电解质溶液。当两极转移的电子数目相等时,阳极、阴极上产生含氮物质的物质的量之比为______________(不考虑水解)。
(3) N2H4可作为火箭燃料,其在氧气中燃烧生成一种无毒气体和水。当有16 g N2H4燃烧时,转移电子的数目约为_________________个。
(4)利用氨气可除去工厂烟气中的氮氧化物。写出氨气与氮氧化物(用NOx表示)反应的化学方程式:___________________________________。同温同压下,3.5 L NH3恰好与3.0 L NO和NO2的混合气完全反应,最终转化为N2,则原混合气中NO和NO2的体积之比是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面列出了几组物质,请将物质的合适组号填写在横线上。
同位素____;同一种物质___;同系物____;同分异构体____;同素异形体___。
①金刚石与石墨; ②D与T; ③12C和13C; ④O2与O3; ⑤CH4和CH3CH2CH3;⑥CH2=CHCH3和CH2=CH2;⑦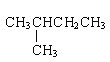 和CH3(CH2)3CH3 ⑧
和CH3(CH2)3CH3 ⑧ 和
和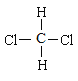
⑨三氯甲烷和氯仿 ⑩CH2=CHCH3和![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com