
【题目】下图所示转化关系中A、B、C均为双原子气态单质,分别由短周期主族元素X、Y、Z组成。其中单质B含共用电子对数最多,甲和丙分子中均含有10个电子。下列说法正确的是( )
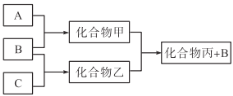
A.化合物乙是一种酸性氧化物B.丙沸点比甲高,是因为丙的相对分子质量更大
C.原子半径大小关系X<Y<ZD.X、Y、Z三种元素形成的化合物不一定是强酸
【答案】D
【解析】
A、B、C均为双原子气态单质,分别由短周期主族元素X、Y、Z组成,其中单质B含共用电子对数最多(为氮气),甲和丙分子中均含有10个电子(可能为甲烷、氨气、水、氟化氢等);由题中转化信息可知,X、Y、Z分别是H、N、O,甲、乙、丙分别是NH3、NO、H2O。
A. 化合物乙是NO,是不成盐氧化物,A错误;
B. 丙是H2O,甲是NH3,H2O的沸点高于NH3,主要是因为水分子间的氢键键能更大,B错误;
C. X、Y、Z分别是H、N、O,同一周期,从左到右,原子半径减小,所以原子半径:N>O,C错误;
D. H、N、O也可形成化合物HNO2,属于弱酸,D正确;
故答案为:D。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)将等径圆球在二维空间里进行排列,可形成密置层和非密置层,在图1所示的半径相等的圆球的排列中,A属于________层,配位数是________;B属于________层,配位数是________。
(2)将非密置层一层一层地在三维空间里堆积,得到如图2所示的一种金属晶体的晶胞,它被称为简单立方堆积,在这种晶体中,金属原子的配位数是________,平均每个晶胞所占有的原子数目是________。

(3)有资料表明,只有钋的晶体中的原子具有如图2所示的堆积方式,钋位于元素周期表的第________周期第__________族,元素符号是________,最外电子层的电子排布式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释有关事实的方程式不正确的是
A.铝热法炼铁:Fe2O3+ 2Al![]() Al2O3+ 2Fe
Al2O3+ 2Fe
B.工业上用NH3制备NO:4NH3+ 5O2![]() 4NO十6H2O
4NO十6H2O
C.向受酸雨影响的湖泊中喷洒CaCO3粉末:CO![]() +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
D.淀粉酿酒:(C6H10O5)n+nH2O![]() n C6H12O6,C6H12O6
n C6H12O6,C6H12O6![]() 2C2H5OH+2CO2
2C2H5OH+2CO2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx是大气污染的主要污染物之一。
(1)NOx能形成酸雨,写出NO2完全转化为HNO3的总反应的化学方程式:_______________________
(2)硝酸厂常用如下两种方法处理NOx尾气。
①催化还原法:在催化剂存在时用H2将NO2还原为N2,写出该反应的化学方程式:_________________
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2,若9.2gNO2和Na2CO3溶液完全反应时转移0.1 mol电子,则反应的离子方程式为______________________________
(3)在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。
①当尾气中空气不足时,NO在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:_______________________________
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOx生成盐。第II A族金属氧化物吸收能力顺序如下:12 MgO<20CaO<38SrO<56BaO。原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为___________,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________(填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________。用pH试纸测定该氨水pH的操作方法为_______________________________________________________。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=_______________________________,25 ℃时,氨水电离平衡常数约为___________。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)___________(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。
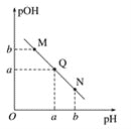
图中M、Q、N三点所示溶液呈中性的点是___________(填字母,下同)。
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率说法正确的是( )
A.对于A(s)+B(g)![]() 2C(g)的反应,增加A的质量,反应速率加快
2C(g)的反应,增加A的质量,反应速率加快
B.对于反应N2O5![]() 2NO2+O2(正反应吸热),升高温度,v(正)减小,v(逆)增大
2NO2+O2(正反应吸热),升高温度,v(正)减小,v(逆)增大
C.恒温恒容下反应2SO2(g)+O2(g)![]() 2SO3(g),充入氦气不改变化学反应速率
2SO3(g),充入氦气不改变化学反应速率
D.1 mol·L-1稀盐酸与锌反应时,加入少量3 mol·L-1稀硝酸,生成H2的速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学配制一定物质的量浓度的NaOH溶液时,造成所配制溶液浓度偏高的原因是( )
A. 转移时容量瓶未干燥
B. 定容时俯视刻度线
C. 没有洗涤烧杯和玻璃棒
D. 用带游码的托盘天平称2.4 g NaOH时误用了“左码右物”方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T℃,向体积不等的恒容密闭容器中分别加入足量活性炭和1mol NO2,发生反应:2C(s)+2NO2(g)N2(g)+2CO2(g)反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。下列说法正确的是

A.T℃时,该反应的化学平衡常数为![]()
B.图中c点所示条件下,v(正)>v(逆)
C.向a点平衡体系中充入一定量的NO2,达到平衡时,NO2的转化率比原平衡大
D.容器内的压强:Pa:Pb>6:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在生产生活中应用广泛。回答下列问题:
I.单质碘与氟反应可得IF5,实验表明液态IF5具有一定的导电性原因在于IF5的自偶电离(如:2H2OH3O++OH-),IF5的自偶电离方程式为_________。
II.一种回收并利用含碘(I-)废液的工艺流程如下:

(1)含碘废水中碘的存在形式一般有I2、I-。检验是否含I2及I-的方法是_______________。
(2)“沉淀”中生成CuI的离子方程式为_______________。
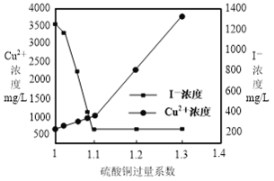
(3)CuSO4的投加量对废水中I-的去除量影响较大,不同投加量(用过量系数表示)下,反应后I-和Cu2+的浓度如图所示,则适宜的CuSO4过量系数应为_______________,分析原因_______________。
(4)反应Ⅰ中生成铁与碘的化合物(其中铁与碘的质量比为21:127),则加入的水的作用是__________,反应Ⅱ的化学方程式是_____________________________。
(5)氯化银复合吸附剂可有效吸附碘离子。氯化银复合吸附剂对碘离子的吸附反应为I-(aq)+AgCl(s) AgI(s)+Cl-(aq),反应达到平衡后溶液中c(Cl-)=0.10molL-1。则溶液中c(I-)= ______molL-1。[Ksp(AgCl)=2.0×10-10,Ksp (AgI)=8.4×10-17]。该方法能去除碘离子的原理是_________。
(6)准确称取产品0.1000g溶于50mL水,加入适量乙酸并加入曙红钠指示剂,然后用0.025mol·L-1AgNO3溶液滴定,至终点时消耗AgNO3溶液22.00mL,则产品中KI的质量分数为____________(保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com