
【题目】将物质X逐渐加入(或通入)Y溶液中,其生成沉淀的物质的量与加入X的物质的量的关系如下图所示,符合图示情况的是

A.AB.BC.CD.D
【答案】C
【解析】
A.石灰水中通入二氧化碳,先发生反应Ca(OH)2+CO2=CaCO3↓+H2O,生成CaCO3沉淀,当Ca(OH)2溶液反应完后,再继续通入CO2发生反应CO2+CaCO3+H2O=Ca(HCO3)2,沉淀消失,所以前后两个过程消耗CO2的物质的量之比为1∶1,与图像不符,故A错误;
B.偏铝酸钠溶液中加入盐酸,先发生反应AlO2-+H++H2O=Al(OH)3↓,生成Al(OH)3沉淀,当偏铝酸钠溶液反应完后,再继续加入盐酸发生反应Al(OH)3+3H+=Al3++3H2O,沉淀消失,所以前后两个过程消耗HCl的物质的量之比为1∶3,与图像不符,故B错误;
C.氯化铝溶液中加入氢氧化钠溶液中,先发生反应Al3++3OH-=Al(OH)3↓,生成Al(OH)3沉淀,当氯化铝溶液反应完后,再滴入氢氧化钠溶液发生反应Al(OH)3+NaOH=NaAlO2+2H2O,沉淀溶解,所以前后两个过程消耗氢氧化钠的物质的量之比为3∶1,与图像相符,故C正确;
D.氢氧化钠溶液中滴入氯化铝溶液,先发生反应Al3++4OH-=AlO2-↓+2H2O,不生成沉淀,当氢氧化钠溶液反应完后,再滴入氯化铝溶液发生反应3AlO2-+Al3++6H2O=4Al(OH)3↓,生成沉淀至最大值并保持不变,与图像不符,故D错误;
故选C。


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】某化学小组以铝土矿(含 Al2O3、Fe2O3和 SiO2)为原料进行炼铝探究(流程如下),叙述错误的是
![]()
A. 步骤①②过程中均需过滤操作
B. a、b中铝元素的化合价相同
C. 反应③的化学方程式为:2 NaAlO2+3H2O+CO2 = 2Al(OH)3↓+Na2CO3
D. d只能是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米微晶![]() (碱式碳酸锌)属于高端精细化工产品,晶粒粒度在
(碱式碳酸锌)属于高端精细化工产品,晶粒粒度在![]() ,不溶于水和醇。某高校实验室用工业级硫酸锌(主要成分为
,不溶于水和醇。某高校实验室用工业级硫酸锌(主要成分为![]() ,含少量
,含少量![]() )制备纳米微晶碱式碳酸锌样品的流程如图所示:
)制备纳米微晶碱式碳酸锌样品的流程如图所示:
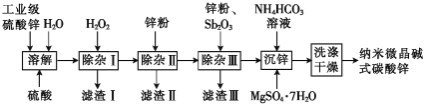
已知:a.![]() 的
的![]() 分别是37.4、15.4、16.2。
分别是37.4、15.4、16.2。
b.残留在溶液中的离子浓度小于![]() 时可认为沉淀完全。
时可认为沉淀完全。
c.滤渣Ⅲ所含主要金属元素是![]() 。
。
(1)“除杂Ⅰ”的目的是除去溶液中的铁元素,则![]() 的作用是________________;若溶液中
的作用是________________;若溶液中![]() ,此过程中还应调节溶液的
,此过程中还应调节溶液的![]() 在____范围(不考虑离子间的相互影响)。
在____范围(不考虑离子间的相互影响)。
(2)“除杂Ⅱ”与“除杂Ⅲ”均为还原除杂。
①滤渣Ⅱ的主要金属元素是_________________________
②“除杂Ⅲ”中加入的![]() 在溶液中主要以
在溶液中主要以![]() 形式存在。请写出锌与
形式存在。请写出锌与![]() 反应生成“金属间化合物”
反应生成“金属间化合物”![]() (
(![]() 中各元素化合价视为0价)的离子方程式:___________________________
中各元素化合价视为0价)的离子方程式:___________________________
(3)“沉锌”后得到的固体先用去离子水洗涤,再用乙醇洗涤。用乙醇洗涤的目的是_______________________
(4)加入![]() 的主要目的是降低样品晶粒粒度,但主元素
的主要目的是降低样品晶粒粒度,但主元素![]() 的质量分数必须在56%以上。若镁、锌的质量比值过高,
的质量分数必须在56%以上。若镁、锌的质量比值过高,![]() 还可能会生成_________(填化学式),从而对样品造成影响。
还可能会生成_________(填化学式),从而对样品造成影响。
(5)样品中锌的含量可用![]() (可表示为
(可表示为![]() )滴定测定,反应的离子方程式为
)滴定测定,反应的离子方程式为![]() 。取
。取![]() 纳米微晶碱式碳酸锌样品,酸溶后得到pH为5~6的溶液,以二甲酚橙作指示剂,用
纳米微晶碱式碳酸锌样品,酸溶后得到pH为5~6的溶液,以二甲酚橙作指示剂,用![]() 标准溶液滴定,消耗
标准溶液滴定,消耗![]() 溶液
溶液![]() ,则样品中锌的质量分数是_______(用代数式表示)。
,则样品中锌的质量分数是_______(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
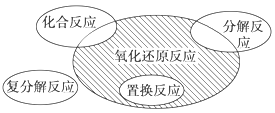
A.Cl2+2KBr=Br2+2KClB.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3D.2Na2O2+2CO2=2Na2CO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(含有CCl4、I2、I-等)中回收碘,向废液中加入Na2SO3溶液反应后进行分离除去CCl4,再向反应液中通入Cl2进行氧化、富集等系列操作获得碘单质。下列说法不正确的是:
A.加入Na2SO3溶液发生的氧化还原反应为:SO32-+I2+H2O=SO42-+2I-+2H+
B.氧化时应控制在较低温度(40℃左右),可增大Cl2的溶解度并减少I2的损失
C.分离除去CCl4的操作为萃取,应在分液漏斗中进行
D.工业上常在干海带浸泡液中通入适量氯气,再采用过滤的方法得到粗碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组利用石油分馏产品合成一种新型香料的流程图如下。
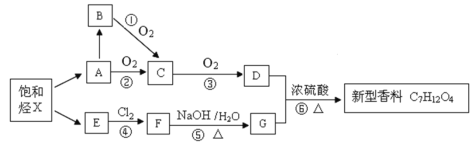
已知X分子中碳氢质量比为24∶5,X有多种裂解方式,其中A、E都是X的裂解产物,且二者互为同系物,D与饱和NaHCO3溶液反应产生气体。
信息提示:卤代烃在强碱水溶液中发生水解(取代)反应生成醇。如:R-CH2CH2Cl![]() RCH2CH2OH+HCl(水解反应)
RCH2CH2OH+HCl(水解反应)
(1)C中官能团的名称为______________。
(2)请写出X的直链结构简式______________。
(3)下列说法正确的是______________。
A.可用金属钠鉴别B和G
B.E在一定条件下与氯化氢发生加成反应的产物有2种
C.D和G以1:1反应可生成分子式为C5H10O2的有机物
D.E→F的反应类型为取代反应
(4)请写出A→B的反应______________。
(5)B与D在浓硫酸作用下生成甲,写出与甲同类别的同分异构体的结构简式______________(不包括甲)。
(6)写出⑥的化学反应方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2可作为能源和化工原料,应用十分广泛。工业上可利用CO或CO2与H2反应来制备甲醇。
反应①:2H2(g)+CO(g)![]() CH3OH(g)△H=-90.8kJ·mol-1
CH3OH(g)△H=-90.8kJ·mol-1
反应②:H2(g)+CO2(g)![]() H2O(g)+CO(g)△H=+41.2kJ·mol-1
H2O(g)+CO(g)△H=+41.2kJ·mol-1
(1)写出用CO2与H2反应制备甲醇的热化学方程式______________。
(2)已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
升高温度,该平衡的移动方向是______________(填“正向”或“逆向”)。500℃时,CO和H2O的起始浓度均为0.020mol·L-1,该条件下CO的平衡浓度为:______________mol·L-1。
(3)一定条件下,可以由CO2(g)和H2(g)合成CH4(g),同时还生成H2O(g)。向恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,10min达到平衡时部分物质的量浓度如图所示,该温度下的的平衡常数等于_______________。
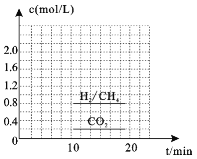
(4)若在20min时减小压强,并在30min时达到平衡状态,请在图2中画出H2的物质的量浓度随时间变化的图像__________________。
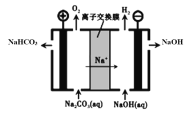
(5)工业上电解Na2CO3溶液可以生成NaHCO3和NaOH两种工业重要原料,装置如图所示。请写出阳极的电极反应式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)→C(g) Δ H ,分两步进行:① A(g)+B(g)→X(g) Δ H1;② X(g)→C(g) Δ H2;反应过程中能量变化如图所示。下列说法正确的是
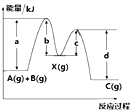
A.d是反应②的活化能
B.Δ H1 = (b - a) kJ ·mol-1
C.Δ H = - (b - c + d - a) kJ·mol-1
D.X是反应A(g) + B(g) → C(g) 的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com