
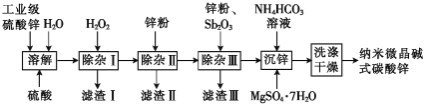
【题目】纳米微晶![]() (碱式碳酸锌)属于高端精细化工产品,晶粒粒度在
(碱式碳酸锌)属于高端精细化工产品,晶粒粒度在![]() ,不溶于水和醇。某高校实验室用工业级硫酸锌(主要成分为
,不溶于水和醇。某高校实验室用工业级硫酸锌(主要成分为![]() ,含少量
,含少量![]() )制备纳米微晶碱式碳酸锌样品的流程如图所示:
)制备纳米微晶碱式碳酸锌样品的流程如图所示:
已知:a.![]() 的
的![]() 分别是37.4、15.4、16.2。
分别是37.4、15.4、16.2。
b.残留在溶液中的离子浓度小于![]() 时可认为沉淀完全。
时可认为沉淀完全。
c.滤渣Ⅲ所含主要金属元素是![]() 。
。
(1)“除杂Ⅰ”的目的是除去溶液中的铁元素,则![]() 的作用是________________;若溶液中
的作用是________________;若溶液中![]() ,此过程中还应调节溶液的
,此过程中还应调节溶液的![]() 在____范围(不考虑离子间的相互影响)。
在____范围(不考虑离子间的相互影响)。
(2)“除杂Ⅱ”与“除杂Ⅲ”均为还原除杂。
①滤渣Ⅱ的主要金属元素是_________________________
②“除杂Ⅲ”中加入的![]() 在溶液中主要以
在溶液中主要以![]() 形式存在。请写出锌与
形式存在。请写出锌与![]() 反应生成“金属间化合物”
反应生成“金属间化合物”![]() (
(![]() 中各元素化合价视为0价)的离子方程式:___________________________
中各元素化合价视为0价)的离子方程式:___________________________
(3)“沉锌”后得到的固体先用去离子水洗涤,再用乙醇洗涤。用乙醇洗涤的目的是_______________________
(4)加入![]() 的主要目的是降低样品晶粒粒度,但主元素
的主要目的是降低样品晶粒粒度,但主元素![]() 的质量分数必须在56%以上。若镁、锌的质量比值过高,
的质量分数必须在56%以上。若镁、锌的质量比值过高,![]() 还可能会生成_________(填化学式),从而对样品造成影响。
还可能会生成_________(填化学式),从而对样品造成影响。
(5)样品中锌的含量可用![]() (可表示为
(可表示为![]() )滴定测定,反应的离子方程式为
)滴定测定,反应的离子方程式为![]() 。取
。取![]() 纳米微晶碱式碳酸锌样品,酸溶后得到pH为5~6的溶液,以二甲酚橙作指示剂,用
纳米微晶碱式碳酸锌样品,酸溶后得到pH为5~6的溶液,以二甲酚橙作指示剂,用![]() 标准溶液滴定,消耗
标准溶液滴定,消耗![]() 溶液
溶液![]() ,则样品中锌的质量分数是_______(用代数式表示)。
,则样品中锌的质量分数是_______(用代数式表示)。
【答案】将![]() 氧化成
氧化成![]() ,以便形成氢氧化铁沉淀而除去 3.2≤pH<5.9 Cu、Cd
,以便形成氢氧化铁沉淀而除去 3.2≤pH<5.9 Cu、Cd ![]() 去除固体表面的水,便于干燥
去除固体表面的水,便于干燥 ![]() [或
[或![]() ]
] ![]()
【解析】
根据工艺流程分析可知,工业级硫酸锌加水、硫酸溶解酸化后加入H2O2,将Fe2+氧化为Fe3+,控制pH将其沉淀为Fe(OH)3,过滤除去,除杂Ⅱ向滤液中加入锌粉,除去Cu2+和Cd2+,除杂Ⅲ再加入锌粉和少量Sb2O3,形成锑锌原电池,除去Co2+、Ni2+,过滤,再向滤液中加入NH4HCO3溶液和MgSO4·7H2O沉锌,洗涤干燥沉淀可得到产品,据此分析解答。
(1) “除杂Ⅰ”的目的是除去溶液中的铁元素,加入适量的H2O2溶液,可将Fe2+氧化为Fe3+,以便形成氢氧化铁沉淀而除去,已知![]() 的
的![]() 分别是37.4、15.4、16.2,则Ksp[Fe(OH)3]=10-37.4,Ksp[Zn(OH)2]=10-16.2,若溶液中c(Zn2+)=1.0mol/L,Zn(OH)2开始沉淀时,Ksp[Zn(OH)2]=c(Zn2+)×c2(OH-),则
分别是37.4、15.4、16.2,则Ksp[Fe(OH)3]=10-37.4,Ksp[Zn(OH)2]=10-16.2,若溶液中c(Zn2+)=1.0mol/L,Zn(OH)2开始沉淀时,Ksp[Zn(OH)2]=c(Zn2+)×c2(OH-),则![]() ,c(H+)=10-5.9mol/L,此时溶液的pH=5.9,要使Zn2+不沉淀,则pH<5.9,残留在溶液中的离子浓度小于
,c(H+)=10-5.9mol/L,此时溶液的pH=5.9,要使Zn2+不沉淀,则pH<5.9,残留在溶液中的离子浓度小于![]() 时可认为沉淀完全,则Fe3+完全沉淀时,c(Fe3+)=1.0×10-5mol/L,Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-),则
时可认为沉淀完全,则Fe3+完全沉淀时,c(Fe3+)=1.0×10-5mol/L,Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-),则![]() ,c(H+)=10-3.2mol/L,此时溶液的pH=3.2,要使Fe3+完全沉淀,则pH≥3.2,故答案为:将
,c(H+)=10-3.2mol/L,此时溶液的pH=3.2,要使Fe3+完全沉淀,则pH≥3.2,故答案为:将![]() 氧化成
氧化成![]() ,以便形成氢氧化铁沉淀而除去;3.2≤pH<5.9;
,以便形成氢氧化铁沉淀而除去;3.2≤pH<5.9;
(2)①除杂Ⅱ向滤液中加入锌粉还原除去Cu2+和Cd2+,滤渣Ⅱ的主要成分是Cu、Cd,故答案为:Cu、Cd;
②Zn与Co2+、HSbO2生成“金属间化合物”CoSb(CoSb中各元素的化合价视为0价),Co元素的化合价由+2价降低至0价,Sb元素的化合价由+3价降低至0价,则生成CoSb化合价降低5价,而Zn元素的化合价由0价升高至+2价,根据得失电子守恒配平该反应的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)碱式碳酸锌不溶于乙醇,且乙醇与水互溶,用乙醇洗涤可去除固体表面的水,便于干燥,故答案为:去除固体表面的水,便于干燥;
(4)若镁、锌的质量比值过高,Mg2+浓度较大,可能会生成![]() [或
[或![]() ],故答案为:
],故答案为:![]() [或
[或![]() ];
];
(5)根据![]() 可知,Zn2+~EDTA(H2Y2-),则n(Zn2+)=n(EDTA),则样品中锌的质量分数是
可知,Zn2+~EDTA(H2Y2-),则n(Zn2+)=n(EDTA),则样品中锌的质量分数是![]() ,故答案为:
,故答案为:![]() 。
。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g) △H=+180.50kJ·mol-1
2NO(g) △H=+180.50kJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) △H=–566.00kJ·mol-1
2CO2(g) △H=–566.00kJ·mol-1
(1)为了减轻大气污染,人们设想提出在汽车尾气排气管口将NO和CO转化成无污染气体参与大气循环。写出该反应的热化学方程式:_______________________________,该想法能否实现______(填“能”或“不能”)。
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0~15min)中NO的物质的量随时间变化的关系如图甲所示。

①T℃时该化学反应的平衡常数K=_________,平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将_________(填“向左”“向右”或“不)移动。
②图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中,n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是________(填“a”或“b”)。
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,发生_____(填“氧化”或“还原”)反应,则该反应的还原剂是________。
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为____。
(3)根据上述反应可推知________(填序号)。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>HBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。_____________
![]() +
+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.向氨水中加入少量的硫酸氢钠,溶液碱性减弱
B.每升pH=3的H2C2O4 溶液中H+数目为0.003NA
C.常温下,CH3COONa溶液中加水,水电离产生的c(H+)、c(OH-)保持不变
D.0.1molFeCl3溶于水形成的Fe(OH)3胶体粒子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯二氧化碳主要用于医学研究及临床诊断及电子工业;含碳的有机物醇、醛在生产生活中有广泛运用。
I.(1)工业上用CO2和H2在一定条件下反应可合成二甲醚,已知:
2CO2(g)+6H2(g)=2CH3OH(g)+2H2O(g) △H1=-107.4kJ/mol
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H2=-23.4kJ/mol
则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=________kJ/mol
CH3OCH3(g)+3H2O(g) △H3=________kJ/mol
(2)在一定条件下将CO2和H2充入一固定容积的密闭容器中,在两种不同温度下发生反应:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g),测得CH3OCH3(g)的物质的量随时间的变化如图所示。
CH3OCH3(g)+3H2O(g),测得CH3OCH3(g)的物质的量随时间的变化如图所示。
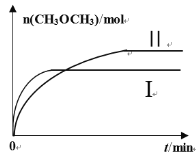
①曲线I、Ⅱ对应的平衡常数大小关系为KI_______KⅡ(填“>”“=”或“<”)。
②一定温度下,下列能判断该反应达到化学平衡状态的是________(填序号)。
a.混合气体密度不变
b.二甲醚和水蒸气的反应速率之比保持不变
c.v正(H2)=2v逆(H2O)
d.2个C=O断裂的同时有3个H-O断裂
(3)合成气CO和H2在一定条件下能发生如下反应:CO(g)+2H2(g)![]() CH3OH(g) △H。在某压强下,合成甲醇的反应在不同温度、不同投料比时,CO的转化率如图所示。
CH3OH(g) △H。在某压强下,合成甲醇的反应在不同温度、不同投料比时,CO的转化率如图所示。
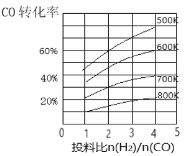
①600K温度下,将1molCO和4molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(H2)=___________。
②若投料比保持不变,升高温度,该反应平衡向_______方向移动(填“正反应”或“逆反应”)。
③上述合成甲醇的过程中提高CO的转化率可采取的措施有______。(列举一种即可)。
Ⅱ.用隔膜电解法处理高浓度乙醛废水的原理为:
使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,总反应为:2CH3CHO+H2O![]() CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程。
CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程。
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极产生气体的电极反应为:______。
②在实际工艺处理过程中,阴极区乙醛的去除率可达80%。若在两极区分别注入1m3乙醛含量为400mg/L的废水,可得到乙醇________kg(计算结果保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D1、D2、E、F、G、H均为有机化合物,请根据下列图示回答问题。
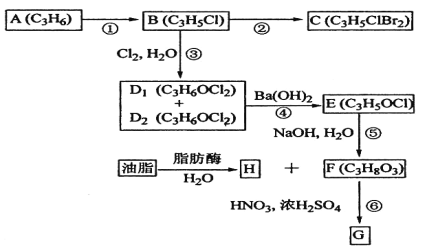
(1)直链有机化合物A的结构简式是__________________;
(2)B中官能团的名称为___________;
(3)①的反应试剂和反应条件是__________;
(4)D1或D2生成E的化学方程式是___________________________________;
(5)G可应用于医疗、爆破等,由F生成G的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
(I)汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:![]()
![]()
![]()
![]()
若某反应的平衡常数表达式为![]() ,则此反应的热化学方程式为_______。
,则此反应的热化学方程式为_______。
(2)![]() 在一定条件下可发生分解:
在一定条件下可发生分解:![]() ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量![]() 进行该反应,能判断反应已达到化学平衡状态的是_____(填字母)。
进行该反应,能判断反应已达到化学平衡状态的是_____(填字母)。
a. ![]() 和
和![]() 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化
c. ![]() d. 气体的密度保持不变
d. 气体的密度保持不变
(Ⅱ)甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。 CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
(3)将![]() 和
和![]() 按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成
按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成![]() ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下![]() 转化率随温度的变化关系。
转化率随温度的变化关系。
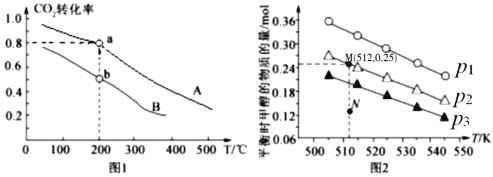
①a、b两点化学反应速率分别用![]() ,表示,则
,表示,则![]() _____
_____![]() (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
②列出a点对应的平衡常数表达式K= ____________________。
(4)在1.0 L恒容密闭容器中投入1 mol ![]() 和2.75 mol
和2.75 mol ![]() 发生反应:
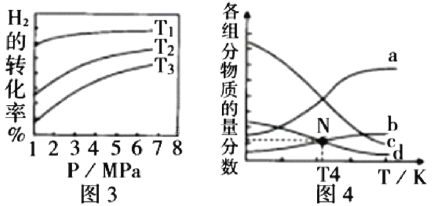
发生反应:![]() CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是________。
CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是________。
A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为![]()
D.在![]() 及512 K时,图中N点
及512 K时,图中N点![]()
(5)![]() 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g) ![]() C2H5OH(g) + 3H2O(g)
C2H5OH(g) + 3H2O(g) ![]() ;m代表起始时的投料比,即
;m代表起始时的投料比,即![]() 。
。
① 图3中投料比相同,温度![]() ,则该反应的焓变
,则该反应的焓变![]() _______0(填
_______0(填![]() )。
)。
② m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_________(填化学式)。
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。离子交换膜a为 ______(填“阳膜”、“阴膜”),阳极的电极反应式为_______________________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是 ( )
A. 向Ba(OH)2溶液中滴加NaHSO4溶液至沉淀刚好完全:Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2 H2O
B. AlCl3溶液中加入过量氨水:Al3++4OH-=== ![]() +2H2O
+2H2O
C. 向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
D. 澄清石灰水和碳酸钠溶液反应:Ca(OH)2+CO32-=CaCO3↓+OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com