
下列说法正确的是
| A.氧化剂得电子数越多其氧化能力越强 | B.发生化学键断裂的过程不一定发生化学反应 |
| C.常温下所有的吸热反应都不能自发进行 | D.两种难溶物溶解度小的物质其Ksp一定也小 |
B
解析试题分析:A.氧化剂氧化能力的大小是看其得到电子的难易,而并非是得到电子的多少。错误。B.金属或离子化合物在熔化时发生化学键断裂,但是并没有产生新的物质,所以没有发生化学变化。故发生化学键断裂的过程不一定发生化学反应。正确。C. 因常温下自发进行的反应虽多为放热反应,但也有不少吸热反应也可自发进行,在一定条件下,一个化学反应能否自发进行,既可能与反应焓变有关,又可能与熵变有关。还有些反应低温下不能自发进行但高温下却可以自发进行。N2O5(g)= 4NO2(g)+ O2(g) △H = +56.7KJ/mol就是一个例子。错误。D.难溶物的Ksp是达到沉淀溶解平衡时各离子的浓度的乘积。这不仅与物质的溶解度的大小有关,还与构成物质的基本微粒的个数有关。难溶物溶解度越小,过程该物质的基本微粒的个数越少,其Ksp一越小。错误。
考点:考查氧化还原反应中氧化性、还原性强弱的比较、化学键与化学反应的关系、反应的自发性与反应放热、吸热的关系、KSP与物质溶解度大小的关系等知识。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.氧化还原反应中一定有某些元素的化合价发生变化 |
| B.金属离子被还原一定得到金属单质 |
| C.阳离子只有氧化性,阴离子只有还原性 |
| D.在氧化还原反应中,氧化剂与还原剂不可能是同一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在汽车尾气处理装置中常发生如下反应:4CO+2NO2=4CO2+N2。下列对该反应的说法中正确的是
| A.该反应属于置换反应 |
| B.该反应中氧化剂是CO,还原剂是NO2 |
| C.该反应生成14 g N2时,转移8 mol e- |
| D.该反应能减少汽车尾气对环境的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
下列有关说法错误的是
| A.氧化性Cr2O72->Fe3+>SO2 |
| B.K2Cr2O7能将Na2SO3氧化成Na2SO4 |
| C.每有1molK2Cr2O7参加反应,转移电子的数目为6NA |
| D.若6.72 L SO2(标准状况)参加反应,则最终消耗0.2molK2Cr2O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知下列离子在酸性条件下都能氧化KI,它们自身发生如下变化:① Cr2O72-→ Cr3+,②IO3-→ I2,③MnO4-→ Mn2+。如果分别用等物质的量的这些离子氧化足量的KI,得到I2的物质的量由多到少的顺序正确的是
| A.②=③>① | B.①>②=③ | C.②>③>① | D.①=②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下氨气和氧化铜可以发生如下反应:2NH3+3CuO△ 3Cu+N2+3H2O,对此反应的分析合理的是
| A.该反应属置换反应 |
| B.NH3被氧化为N2 |
| C.反应体现了金属铜的还原性 |
| D.每生成1mol H2O 就伴随着1mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O则该反应中化合价发生变化和未发生变化的N原子数之比为
| A.1:4 | B.1:2 | C.2:1 | D.4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现取m g镁铝合金在一定浓度的稀硝酸中恰好完全溶解(硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol·L-1 NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中正确的有( )。
①沉淀中OH-的质量为(n-m)g
②恰好溶解后溶液中的NO3—的物质的量为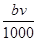 mol
mol
③反应过程中转移的电子数为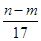 mol
mol
④标准状况下生成NO的体积为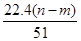 L
L
⑤与合金反应的硝酸的物质的量为(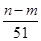 +
+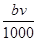 )mol
)mol
| A.5项 | B.4项 | C.3项 | D.2项 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com