
【题目】已知:某二元酸H2XO4在水中电离分两步:H2XO4=H++HXO4-,HXO4-![]() H++XO42-。常温下,在20mL0.1molL-1NaHXO4溶液中滴加cmolL-1NaOH溶液,溶液温度与溶液体积关系如图所示。下列说法错误的是( )
H++XO42-。常温下,在20mL0.1molL-1NaHXO4溶液中滴加cmolL-1NaOH溶液,溶液温度与溶液体积关系如图所示。下列说法错误的是( )
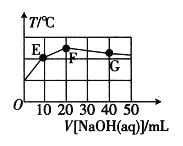
A.该NaOH溶液的pH=13
B.滴加过程中,水的电离程度先变大,后变小
C.F点溶液中c(OH-)>c(HXO4-)
D.G点溶液中c(Na+)=3c(H2XO4)+3c(HXO4-)+3c(XO42-)
【答案】D
【解析】
根据图像可知,NaHXO4与NaOH发生反应是放热反应,当温度达到最高,说明两者恰好完全反应,F点温度最高,此时消耗NaOH的体积为20mL,计算出氢氧化钠的浓度,然后根据影响水电离的因素、“三大守恒”进行分析;
A. 根据图像分析可知,F点温度最高,说明此时两物质恰好完全反应,![]() ,20×10-3L×0.1mol·L-1=20×10-3L×c(NaOH),推出
,20×10-3L×0.1mol·L-1=20×10-3L×c(NaOH),推出![]() ,
,![]() ,故A说法正确;
,故A说法正确;
B. 根据题意,两者恰好完全反应,生成的溶质Na2XO4,属于强碱弱酸盐,即溶质为![]() 时水解程度最大,E到F过程中,水的电离程度增大,F到G过程中,氢氧化钠溶液过量,抑制水的电离,因此滴加氢氧化钠的过程中,水的电离程度先变大,后变小,故B说法正确;
时水解程度最大,E到F过程中,水的电离程度增大,F到G过程中,氢氧化钠溶液过量,抑制水的电离,因此滴加氢氧化钠的过程中,水的电离程度先变大,后变小,故B说法正确;
C. F点溶质为![]() ,溶液中质子守恒为
,溶液中质子守恒为![]() ,所以
,所以![]() ,故C说法正确;
,故C说法正确;
D. 依题意,![]() 第一步完全电离,溶液中不存在
第一步完全电离,溶液中不存在![]() ,故D说法错误;
,故D说法错误;
答案:D。


科目:高中化学 来源: 题型:
【题目】在0.1 mol/L的Na2CO3溶液中,下列关系式正确的是( )
A.c(Na+)=2c(CO32-)B.c(H+)>c(OH-)
C.c(CO32-)+c(HCO3-)=0.1mol/LD.c(HCO3-)<c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎。下图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( )
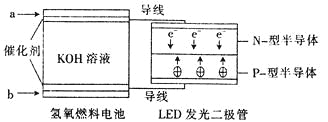
A.a处通人氧气,b处通人氢气
B.该装置中只涉及两种形式的能量转化
C.电池正极电极反应式为O2+2H2O+4e-﹦4OH-
D.P一型半导体连接的是电池负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为________和________。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理为FeS2![]() Fe2++SO42—
Fe2++SO42—![]() Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_______________________,第二步反应的离子方程式为________________。
Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_______________________,第二步反应的离子方程式为________________。
(3)工业煤干馏得到的产品有焦炭、________。
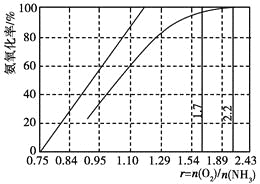
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=________,实际生产要将r值维持在1.7~2.2之间,原因是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中,正确的是
A.C6H5CH2CH2OH与C6H5OH互为同系物
B.CH3CHO与CH3COOH在一定条件下均能与新制氢氧化铜反应
C.![]() 与
与![]() 互为同分异构体
互为同分异构体
D.H2O与D2O互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强碱溶液中加热R﹣Br 容易水解为R﹣OH.某芳香烃A有如下转化关系:
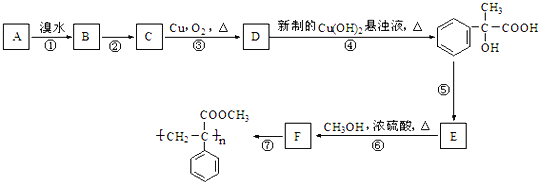
请回答下列问题:
(1)反应①到⑥中消去反应是:_______________。
(2)反应②的条件为:_______________。
(3)A结构简式:_______________。
(4)反应③化学方程式:______________________________________________________。
(5)在E的粗产物中,经检测含有高分子聚合物杂质。写出该高聚物杂质的结构简式:____________。
(6)写出满足下列条件的E的一种同分异构体的结构简式:_______________。
Ⅰ.苯环上的一元取代物只有两种结构;
Ⅱ.能发生银镜反应
Ⅲ.与氯化铁溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)的性质,室温下进行以下两组实验:(已知:室温下,H2C2O4的电离平衡常数Ka1=5.0×10-2,Ka2=5.4×10-5)
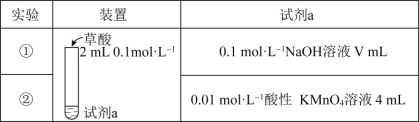
下列有关实验说法正确的是( )
A.若实验①中V=2,则混合后溶液中:c(C2O42-)>c(H2C2O4)
B.若实验①中V=4,则混合后溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-)
C.实验②反应的离子方程式为5C2O42-+16H++2MnO4-=2Mn2++10CO2↑+8H2O
D.若实验②测得KMnO4溶液的褪色时间为40s,则这段时间内的平均反应速率v(KMnO4)=2.5×10-4molL-1s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,AgCl(s)![]() Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A.d点没有AgCl沉淀生成
B.c点对应的Ksp等于a点对应的Ksp
C.加入AgNO3,可以使溶液由c点变到d点
D.加入少量水,平衡右移,Cl-浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,电解质溶液的性质与变化是多样的,下列说法正确的是
A.往稀氨水中加水,溶液中的![]() 值变小
值变小
B.pH相等的①CH3COONa、②NaClO、③NaOH三种溶液中c(Na+)大小:①>②>③
C.pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在下列等式:c(Na+)+c(H+)=c(OH-)+2c(S2-)
D.Ca(ClO)2溶液中通入少量CO2,ClO-水解程度增大,溶液碱性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com