
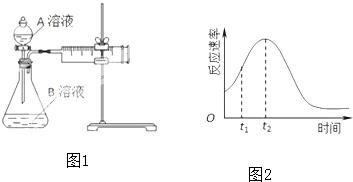
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
| ② | 20mL 0.2mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |


科目:高中化学 来源: 题型:
| 第一组 | 加入0.5g水 | 很快产生火花 |
| 第二组 | 加入1g胆矾 | 约30s产生火花 |
| 第三组 | 加入1g无水硫酸铜 | 1min内没有明显现象 |
| A、水能加快铝和碘的反应 |
| B、第三组铝和硫酸铜发生了置换反应 |
| C、第一组和第二组实验中均放出热量 |
| D、第一组实验中铝和碘发生反应生成了AlI3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
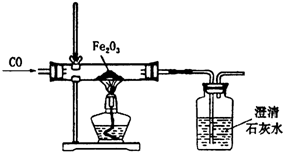 某课外活动小组在实验室条件下探究CO与Fe2O3反应的产物情况,实验设计如图所示.
某课外活动小组在实验室条件下探究CO与Fe2O3反应的产物情况,实验设计如图所示.| 加热时间/min | 0 | 10 | 60 | 120 | 130 |
| 固体质量/g | 24.0 | 23.2 | 21.6 | 16.8 | 16.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
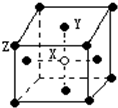 (1)某晶体的晶胞如图所示,X位于体心,Y位于6面心,Z位于顶点,该晶体中 X、Y、Z的粒子个数比为
(1)某晶体的晶胞如图所示,X位于体心,Y位于6面心,Z位于顶点,该晶体中 X、Y、Z的粒子个数比为查看答案和解析>>
科目:高中化学 来源: 题型:
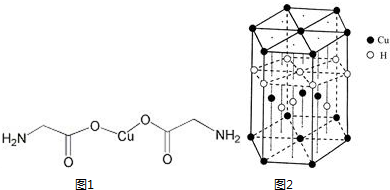 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3?H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3?H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、按系统命名法,化合物  的名称是2,3,5,5-四甲-4,4-二乙基己烷 的名称是2,3,5,5-四甲-4,4-二乙基己烷 |
| B、等质量的乙烯和2-甲基-2-丁烯完全燃烧消耗氧气的量不相等 |
| C、分子式为C10H20的烯烃分子中的10个C原子可能在一个平面上 |
| D、分子式为C8H18的分子中的所有C原子不可能都在一个平面上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com