
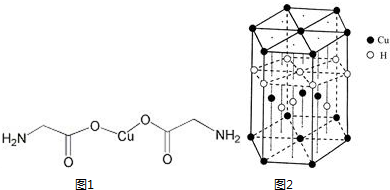
 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3?H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3?H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O| m |
| V |
| 1 |
| 2 |
| 1 |
| 6 |
| 1 |
| 2 |
| 1 |
| 3 |
| 1 |
| 8 |
| 1 |
| 2 |
| 2 |
| 2 |
| 4×64 |
| NA |
| 4×64 | ||
(2
|
| 4×64 | ||
(2
|


科目:高中化学 来源: 题型:
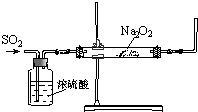 同学们利用如图装置探究SO2与Na2O2的反应.
同学们利用如图装置探究SO2与Na2O2的反应.| 实验步骤编号 | 实验操作 | 预期现象和结论 |
| ① | / | |
| ② | 向①的试管中加入 | |
| ③ | ||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称取7.68 g硫酸铜,加入500 mL水 |
| B、称取12.5 g胆矾配成500 mL溶液 |
| C、称取8.0 g硫酸铜,加入500 mL水 |
| D、称取12.0 g胆矾配成500 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
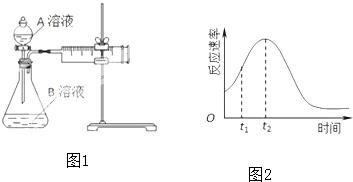
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
| ② | 20mL 0.2mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| r+/r- | 配位数 | 实例 |
| 0.225~0.414 | 4 | ZnS |
| 0.414~0.732 | 6 | NaCl |
| 0.732~1.0 | 8 | CsCl |
| >1.0 | 12 | CsF |
| A、该晶体结构与ZnS晶体相似 | |||||
| B、该晶体每个晶胞中有2个A2+和B2- | |||||
C、该晶体晶胞的边长
| |||||
| D、A2+离子紧邻的B2-构成的空间结构为正方体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2(CO) |
| B、NaHCO3(Na2CO3) |
| C、Na2CO3(NaHCO3) |
| D、NaOH(NaHCO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏烧瓶中要放入碎瓷片防止暴沸 |
| B、温度计的水银球放在支管口稍下位置,不能插入液面 |
| C、冷凝水应该是下进上出,与蒸汽的流向相反 |
| D、开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应该先关冷凝水再撤酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、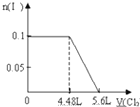 |
C、 |
D、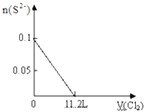 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com