
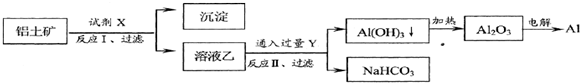
| A、试剂X为稀硫酸 |
| B、结合质子( H+)的能力由强到弱的顺序是:AlO2->OH->CO32- |
| C、反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- |
| D、Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述实验无法确定是否含有Cl-和NO3- |
| B、溶液中肯定含有CO32-和SO42-,且浓度分别为4.00mol/L、2.00mol/L |
| C、上述实验确定溶液中肯定不含有Mg2+、Fe3+、Al3+ |
| D、要确定是否含有K+,应进一步做焰色反应实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
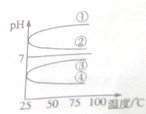 A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:| c(B) |
| c(OH-) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降 |
| B、常温下,c(NH4+)相等的①(NH4)2SO4 ②(NH4)2Fe(SO4)2 ③NH4Cl ④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ |
| C、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| D、当溶液中存在的离子只有Cl-、OH-、NH4+、H+时,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 5 |
| 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
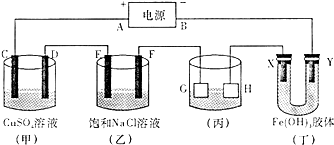 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,装置(丁)中Y极附近红褐色变深,则以下说法正确的是( )
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,装置(丁)中Y极附近红褐色变深,则以下说法正确的是( )| A、电源B端是正极 |
| B、(甲)装置的C、D电极均有单质生成,且其物质的量之比为2:1 |
| C、欲用(丙)装置给铜镀银,H应该是银,电镀液是硝酸银溶液 |
| D、若向(乙)中滴入酚酞溶液,在F极附近先出现红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com