
| A、2种 | B、3种 | C、4种 | D、5种 |
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
| A、A2+2B2=2AB2 |
| B、2A2+B2=2A2B |
| C、3A2+B2=2A3B |
| D、A2+3B2=2AB3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径的大小顺序:rY>rX>rQ>rW |
| B、X、Y的最高价氧化物的水化物之间不能发生反应 |
| C、Z元素的氢化物稳定性大于W元素的氢化物稳定性 |
| D、元素Q和Z能形成QZ2型的共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
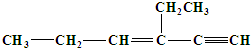 ,分子中含有四面体结构的碳原子数为a,在同一条直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别是( )
,分子中含有四面体结构的碳原子数为a,在同一条直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别是( )| A、4、4、5 |
| B、2、5、4 |
| C、4、3、6 |
| D、4、6、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、对于任何化学反应来说,反应速率越快,反应现象就越明显 |
| B、化学反应速率为0.8 mol/(L?s)是指1秒钟时某物质的浓度为0.8 mol/L |
| C、根据化学反应速率的大小可以知道化学反应进行的快慢 |
| D、化学反应速率是指一定时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成物具有的总能量减去反应物具有的总能量等于该反应的焓变 |
| B、因为该反应为吸热反应,故一定要加热反应才能进行 |
| C、破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 |
| D、1 mol X和1 molY的总能量一定低于1 mol M和1 molN的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com