
| 主族 周期 | IA | ⅡA | ⅢA | IVA | VA | VIA | VⅡA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
 ,C与G形成化合物为氯化镁,为离子化合物,用电子式表示形成过程为:
,C与G形成化合物为氯化镁,为离子化合物,用电子式表示形成过程为: ,
, ;
; ;
;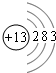 ,则Al位于第三周期ⅢA族,X的氢氧化物与盐酸反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,
,则Al位于第三周期ⅢA族,X的氢氧化物与盐酸反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | 淀粉溶液的 用量/mL | 温度/℃ | 酸 | 加酸后溶液中 c(H+)/mol?L-1 | 蓝色褪去所需的 时间/min |
| 1 | 30 | 50 | 盐酸 | 0.01 | 40 |
| 2 | 30 | T1 | 盐酸 | 0.05 | 20 |
| 3 | 30 | T2 | 盐酸 | 0.10 | 8 |
| 4 | 30 | T3 | 硫酸 | 0.05 | 12 |
| 5 | 30 | T4 | 醋酸 | a | 15 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 2 | ① | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、CH3CH3 |
| B、CH2=CH2和Cl2 |
| C、CH2=CH2和HCl |
| D、CH3CH3和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在容积为1.00L的密闭容器中,通入一定量的N2O4,发生反应:N2O4 (g)?2NO2(g).100℃时,各物质浓度随时间变化如图所示.
在容积为1.00L的密闭容器中,通入一定量的N2O4,发生反应:N2O4 (g)?2NO2(g).100℃时,各物质浓度随时间变化如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com