
【题目】溶于海水的CO2主要以4种无机碳形式存在,其中 HCO3-占95 % ,利用图示装置从海水中提取CO2,有利于减少环境温室气体含量。下列说法正确的是
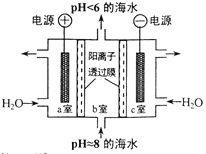
A. a 室排出的是NaOH 、Ca(OH)2等强碱性物质
B. b 室发生主要反应: 2H++ CO32-=== H2O +CO2↑
C. c室发生的反应为 2H2O-4e-===O2↑+ 4H+
D. 装置中产生的 O2和提取的 CO2的体积比约为1:4
【答案】D
【解析】
根据电解原理,写出阳极、阴极反应式,结合海水成分和阳离子交换膜的作用,分析电解池c室发生的变化,进而作出相应判断。
A项:a 室电极与电源正极相连,是电解池阳极,电极反应为2H2O-4e-===O2↑+ 4H+。H+通过阳离子交换膜进入b室,A项错误;
B项:a室生成的H+通过阳离子交换膜进入b室,与主要含碳粒子发生反应HCO3-+H+=H2O +CO2↑,B项错误;
C项:c室电极与电源负极相连,是电解池阴极,电极反应为2H2O+2e-===H2↑+ 2OH-。b室海水中阳离子通过离子交换膜进入c室,故c室排出的是NaOH 、Ca(OH)2等强碱性物质,C项错误;
D项:据阳极反应和b室反应可知,装置中产生的 O2和提取的 CO2的体积比约为1:4,D项正确。
本题选D。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】某实验小组模拟光合作用,采用电解CO2和H2O的方法制备CH3CH2OH和O2装置如图所示。下列说法不正确的是

A. 铂极为阳极,发生氧化反应
B. 电解过程中,H+由交换膜左侧向右侧迁移
C. 阴极的电极反应式为2CO2+12H++12e-====CH3CH2OH+3H2O
D. 电路上转移2mol电子时铂极产生11.2LO2(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用下列装置,进行与氯气相关的实验。
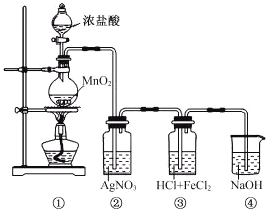
(1)装置④中NaOH溶液的作用是___________。
(2)实验结束后,取装置③中的溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到FeCl3·6H2O晶体。在蒸发浓缩操作中,不需要的仪器是___________。
A.蒸发皿 B.漏斗 C.玻璃棒 D.酒精灯
(3)装置②中出现白色沉淀,据此现象能否推测装置①中生成Cl2___________________,请说明理由_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 标况下,224 L H2O含有的分子数为10NA
B. 1 mol任何气体所含的原子数均为NA
C. 28 g CO所含的分子数为NA
D. 标况下,NA个分子的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)FeCl3的水溶液呈______(填“酸”、“中”、“碱”)性,原因是:________________________(用离子方程式表示);实验室在配制FeCl3的溶液时,常将FeCl3固体先溶于盐酸中,然后再用蒸馏水稀释到所需的浓度,以______(填“促进”、“抑制”)其水解;将FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是______。
(2)测NaClO溶液的pH,可用__________________(填“广泛pH试纸”、“精密pH试纸”、“pH计”);NaClO溶液显碱性的原因是:________________________(用离子方程式表示);已知HClO的Ka=2.95×10-8,碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,则NaClO溶液中通入少量的CO2,所发生的化学方程式为__________。
II.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系
A.c(Cl-)>c (NH4+)>c (H+)>c(OH-)
B.c (Cl-)>c (NH4+)>c (OH-)>c (H+)
C.c(NH4+)>c (Cl-)>c(OH-)>c (H+)
D.c (Cl-)>c (H+)>c (NH4+)>c (OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,该溶质是_______,上述四种离子浓度的大小顺序为____________(填序号);
(2)若上述关系中C是正确的,则溶质为___________________;若上述关系中D是正确的,则溶质为___________________。
(3)若该溶液是体积相等的浓盐酸和氨水混合而成,且恰好是中性,则混合前c(HCl) _______ c (NH3H2O)(大于、小于或等于)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下, 0.1 mol/L的某二元酸 H2A 溶液中,可能存在的所有含 A 粒子的物质的量分数随pH 变化的关系如图所示。下列说法正确的是

A. H2A 的电离方程式:H2A![]() H+ + HA-
H+ + HA-
B. pH = 5 时,在NaHA和Na2A的混合溶液中: c(HA-) : c(A2-)= 1 : 100
C. 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D. NaHA溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】起固氮作用的化学反应的是
A. 工业上用氮气和氢气合成氨气B. 一氧化氮与氧气反应生成二氧化氮
C. 氨气经催化氧化生成一氧化氮D. 由氨气制碳酸氢铵和硫酸铵
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是

A. 含有大量SO42-的溶液中肯定不存在Ag+
B. Ag2SO4的溶度积常数(Ksp)为1×10-3
C. 0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
D. a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下各种说法:
①金属和非金属化合时一定形成离子键;
②离子键是阳离子、阴离子的相互吸引力;
③根据电离方程式HCl![]() H++Cl-,判断氯化氢分子里存在离子键;
H++Cl-,判断氯化氢分子里存在离子键;
④氢气和氯气的反应过程:H2、Cl2分子里共价键发生断裂生成H原子、Cl原子,而后H原子、Cl原子形成离子键的过程
上述各种说法正确的是
A. ①② B. 都不正确 C. ①②④ D. ①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com