
【题目】若把周期表原先的主、副族号取消,由左到右按原顺序编为18纵行。如碱金属为第1纵行,稀有气体为第18纵行,按这个规定,下列说法不正确的是( )
A.计算机芯片的组成元素位于第14纵行
B.第10纵行元素全部是金属元素
C.第18纵行元素单质全部是气体
D.只有第2纵行元素的原子最外层有2个电子
 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 用惰性电极电解熔融氯化钠:2C1-+2H2O![]() C12↑+H2↑+2OH-
C12↑+H2↑+2OH-
B. 氢氧化钠溶液中加入过量的碳酸氢钙溶液: Ca2++2HCO3-+2OH-= CaCO3↓+2H2O+CO32-
C. 漂白粉溶液通入少量的SO2:Ca2++ 2C1O-+SO2+H2O=CaSO3↓+2HC1O
D. 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++ H2O2+2H+=2Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于SiO2的说法中错误的是
A.纯净的SiO2是光纤制品的基本原料
B.SiO2能与NaOH溶液反应生成盐
C.SiO2高温下能与CaO反应生成盐
D.SiO2能与氢氟酸反应,因此它属于碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
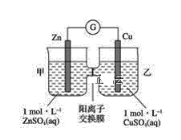
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,乙池溶液的总质量增加
C. 电池工作一段时间后,甲池的c(SO42-)减小
D. 阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火法炼铜得到的粗铜中含有多种杂质(如锌、金和银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时( )
A. 粗铜接电源负极
B. 杂质都将以单质形式沉积到池底
C. 粗铜作阴极
D. 纯铜片增重2.56 g,电路中通过电子的物质的量为0.08 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用“钯催化交叉偶联反应”合成了有机物丙,合成路线如下:
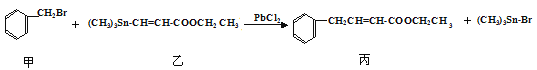
下列分析判断正确的是
A. 分离提纯有机物丙宜在NaOH热溶液中进行
B. 利用NaOH溶液、AgNO3溶液即可确定有机物甲中含有溴元素
C. 可用酸性KMnO4溶液检验有机物丙中是否含有机物乙
D. PbCl2的作用是提高反应物的活性,加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸钠(![]() ,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25 ℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法不正确的是(温度为25 ℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25 ℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法不正确的是(温度为25 ℃,不考虑饮料中其他成分)( )
A. 由于碳酸的酸性弱于HA,充入CO2不能生成HA,因此充入CO2并不能增强抑菌能力
B. pH相同的NaA和NaHCO3溶液,导电能力前者强于后者
C. 当pH为5.0时,饮料中![]() =0.16
=0.16
D. 碳酸饮料中各种粒子的浓度关系为:c(H+) +c(Na+)=c(HCO![]() )+2c(CO
)+2c(CO![]() )+c(OH-)+c(A-)
)+c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)AgNO3光照易分解,生成Ag和红棕色气体等物质,其光照分解反应的化学方程式为___________________________________。
(2)已知Ksp(AgCl)=1.8×10-10,若向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸,混合后溶液中Ag+的浓度为________mol·L-1,pH为________。
(3)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。pH=13时,溶液中的c(H2S)+c(HS-)=________mol·L-1。

(4)25℃,0.10mol·L-1CH3COONH4溶液中粒子浓度由大到小的顺序为____________________(已知醋酸和一水合氨的电离常数相等)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com