
| A、1:1:1 |
| B、1:2:3 |
| C、6:3:2 |
| D、23:24:27 |


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
| A、Cu(OH)2中加入硫酸:OH-+H+═H2O |
| B、钠加入水中:Na+2H2O═Na++2OH-+H2↑ |
| C、FeSO4溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ |
| D、Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 相关实验 | 预期目的 | |
| ① | 将SO2通入溴水,溴水褪色后加热观察能否恢复原色 | 验证SO2漂白的可逆性 |
| ② | 将氯水加入淀粉KI溶液中 | 验证Cl的非金属性比I强 |
| ③ | 在相同温度下,将表面积相同的铝条和镁条投入等体积同浓度的盐酸中,观察产生气泡的速率. | 比较同周期金属元素的金属性强弱. |
| ④ | 利用电解质溶液的导电性装置,检测AlCl3溶液的导电性 | 证明AlCl3是离子化合物 |
| A、仅① | B、①④ | C、②③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①>③>② |
| B、③>①>② |
| C、①>②>③ |
| D、②>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2通入Na2SO3溶液:2Cl2+H2O+SO32-═2HClO+SO2↑+2Cl- |
| B、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
C、水杨酸(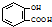 )中加入Na2CO3溶液: )中加入Na2CO3溶液: +CO32-→ +CO32-→ +CO2↑+H2O +CO2↑+H2O |
| D、SO2通入酸性高锰酸钾溶液:5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Va=Vb时:c (CH3COO-)=c (K+) |
| B、Va=Vb时:c (CH3COOH)+c (H+)=c (OH-) |
| C、Va>Vb时:c (CH3COO-)>c (K+)>c (OH-)>c (H+) |
| D、Va与Vb任意比时:c (K+)+c (H+)=c (OH-)+c (CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮气及含氮的化合物在国民经济中占有重要地位.合成氨工业中,合成塔中每产生2mol NH3,放出92.4kJ热量.
氮气及含氮的化合物在国民经济中占有重要地位.合成氨工业中,合成塔中每产生2mol NH3,放出92.4kJ热量.| n(NH3) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活.
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活.| H2O | CO | CO2 | H2 | |
| 甲n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
| 乙n/mol | 0.20 | 0.20 | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com