
 ������ȼ��ʱ�ܷų��������ȣ���Ҳ��Һ��ʯ��������Ҫ�ɷ֣���Ϊ��ԴӦ�������ǵ��ճ����������
������ȼ��ʱ�ܷų��������ȣ���Ҳ��Һ��ʯ��������Ҫ�ɷ֣���Ϊ��ԴӦ�������ǵ��ճ����������| H2O | CO | CO2 | H2 | |
| ��n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
| ��n/mol | 0.20 | 0.20 | 0 | 0 |
| 0.50��0.10 |
| 0.3����0.10 |
| 2.8g |
| 28g/mol |
| 1.8g |
| 18g/mol |
| x2 |
| (0.1-x)2 |
| 0.05mol |
| 0.1mol |
| c(HCO3-)?c(OH-) |
| c(CO32-) |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.1mol?L-1��NaOH��Һ�У�����������Ϊ0.1NA |
| B����״���£�22.4L CHCl3�к���ԭ����Ϊ3NA |
| C��1mol Na2O2������������������ΪNA |
| D�������ʵ�����N2��CO�ķ�������ΪNA�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1��1��1 |
| B��1��2��3 |
| C��6��3��2 |
| D��23��24��27 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| c(OH-) |
| c(NH3?H2O) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
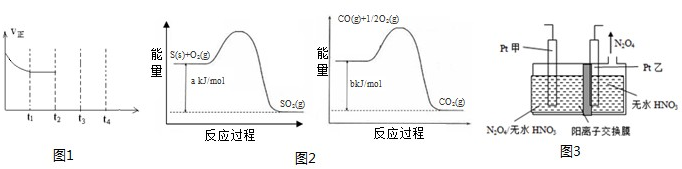
| 180�� |
| ���� |
| ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
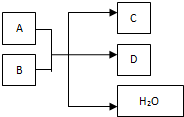 ��һ�������£�ijЩ��ѧ��Ӧ������ͼ��ʾ����ش���������
��һ�������£�ijЩ��ѧ��Ӧ������ͼ��ʾ����ش����������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ����ij��ȤС���ͬѧ����ͼ��ʾװ���о��йص绯ѧ�����⣮���պϸ�װ�õĵ��ʱ���۲쵽�����Ƶ�ָ�뷢����ƫת����ش��������⣺
����ij��ȤС���ͬѧ����ͼ��ʾװ���о��йص绯ѧ�����⣮���պϸ�װ�õĵ��ʱ���۲쵽�����Ƶ�ָ�뷢����ƫת����ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�� | �й���Ϣ |
| A | ���⻯��ˮ��Һ�ʼ��� |
| B | �ؿ��к�������Ԫ�� |
| C | �����뱣����ú���� |
| D | ������NaOH��Һ��Ӧ����������Ư��Һ |
| E | �������������������Ľ���������Ʒ�ڳ�ʪ�������ױ���ʴ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��C+O2
| ||||
B��CaCO3
| ||||
C��2KMnO4
| ||||
| D��Zn+H2SO4=ZnSO4+H2�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com