2013年9月以来,我国很多地区大面积出现雾霾,特别是华中华北尤其严重,汽车尾气、燃煤废气和冬季取暖排放的CO
2等都是形成雾霾的原因.
(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g)
2CO
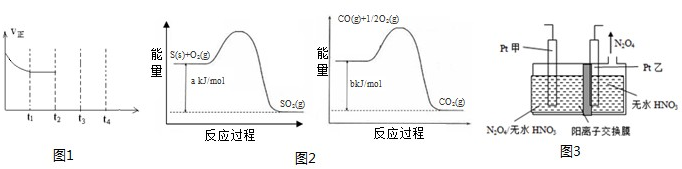
2(g)+N
2(g)△H<0,在一定温度下,如图1在一体积固定的密闭容器中充入一定量的NO和CO在t
1时刻达到平衡状态.
①能判断该反应达到平衡状态的标志是
.
A.在单位时间内生成1mol CO
2的同时消耗了1mol CO
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.混合气体的压强不再变化
②在t
2时刻将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t
3时刻达到新的平衡状态,之后不再改变条件.请在图1中补充画出从t
2到t
4时刻正反应速率随时间的变化曲线:
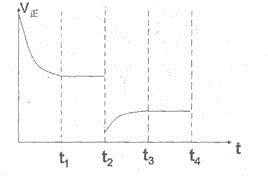
(2)CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题.镍与CO反应的化学方程式为Ni(s)+4CO(g)?Ni(CO)
4(g),镍与CO反应会造成镍催化剂中毒.为防止镍催化剂中毒,工业上常用SO
2除去CO,生成物为S和CO
2.已知相关反应过程的能量变化如图2则用SO
2除去CO的热化学方程式为
.
(3)NH
3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.发生的化学反应是:2NH
3(g)+NO(g)+NO
2(g)
2N
2(g)+3H
2O(g)△H<0.为提高氮氧化物的转化率可采取的措施是(任意填一种)
.
(4)已知反应:CO(g)+H
2O(g)?CO
2(g)+H
2(g),现将不同量的CO(g)和H
2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
| CO |
H2O |
H2 |
CO |
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验1条件下平衡常数K=
(保留小数点后二位);
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是
;
③该反应的△H
O(填“>”或“<”);若在900℃时,另做一组实验,在此容器中加入10mol CO、5mol H
2O、2mol CO
2、5mol H
2,则此时V
正
V
逆(填“>”或“<”);
(5)工业废气中含有的NO
2还可用电解法消除.用NO
2为原料可制新型绿色硝化剂N
2O
5.制备方法之一是先将NO
2转化为N
2O
4,然后采用电解法制备N
2O
5,装置如图3.Pt乙为
极,电解池中生成N
2O
5的电极反应式是
.


 ,
, ;
;

 如图是17世纪炼金家们画的带有浓厚神秘色彩的两种同族元素的元素符号.已知X位于周期表前四周期,Y比X多1个电子层,X、Y都是生产半导体的材料,X的氢化物XH3有剧毒.下列推测不正确的是( )
如图是17世纪炼金家们画的带有浓厚神秘色彩的两种同族元素的元素符号.已知X位于周期表前四周期,Y比X多1个电子层,X、Y都是生产半导体的材料,X的氢化物XH3有剧毒.下列推测不正确的是( )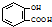 )中加入Na2CO3溶液:
)中加入Na2CO3溶液: +CO32-→
+CO32-→ +CO2↑+H2O
+CO2↑+H2O 氮气及含氮的化合物在国民经济中占有重要地位.合成氨工业中,合成塔中每产生2mol NH3,放出92.4kJ热量.
氮气及含氮的化合物在国民经济中占有重要地位.合成氨工业中,合成塔中每产生2mol NH3,放出92.4kJ热量. 丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活.
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活. A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大.A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4; G+的M层电子全充满.用化学式或化学符号回答下列问题:
A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大.A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4; G+的M层电子全充满.用化学式或化学符号回答下列问题: