
| A、加入水时,平衡向正反应方向移动,溶液中n(H+)增大 |
| B、加入少量冰醋酸,平衡向正反应方向移动,溶液中c(H+)增大 |
| C、加入少量0.1mol?L-HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小 |
| D、加入少量CH3COONa固体,平衡向逆反应方向移动,溶液中c(H+)减小 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、Fe分别与盐酸和氯气在一定条件下反应,生成物的价态 |
| B、等质量的Fe分别在空气中氧化或与水蒸气高温反应转移的电子数 |
| C、相同状况,等质量的Al分别与足量盐酸或NaOH溶液反应生成的H2体积 |
| D、等浓度等体积的盐酸和NaOH溶液分别与足量Al反应生成的H2质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,体积相同的CO和N2所含的分子数和质量都相等 |
| B、同温同压下,22.4L的氢气和氯气都含有6.02×1023个分子 |
| C、在20°C,压强为101KPa时,1molO2和1molCO所含有的原子数相等 |
| D、在标准状况下,11.2L氧气的质量是16g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有的分子数为NA |
| B、含有氧原子2mol |
| C、体积是22.4L |
| D、质量是44g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属性:X>Y>Z |
| B、X、Y、Z的最高价氧化物的水化物酸性由弱到强 |
| C、气体氢化物的稳定性,按X、Y、Z顺序递减 |
| D、X、Y、Z的最外层电子数依次减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸的摩尔质量是98g |
| B、2mol水的质量是18g/mol |
| C、氯化氢的摩尔质量等于它的相对分子质量 |
| D、22g二氧化碳的物质的量是0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验剩余的任何药品不能放回原试剂瓶 |
| B、用规格为10mL的量筒量取6mL的液体 |
| C、使用胶头滴管时,应使滴管始终垂直向下,一般不得伸入容器内 |
| D、粗盐提纯操作的顺序是:溶解、过滤、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:

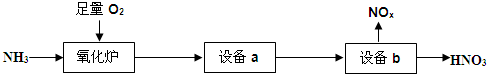
查看答案和解析>>
科目:高中化学 来源: 题型:
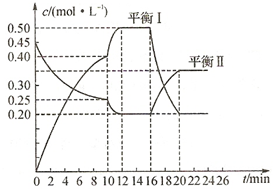 向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com