
【题目】有一包白色粉末,其中可能含有KCl、Ba(NO3)2、CuSO4、Na2CO3,现通过以下实验流程进行检验(假设物质间的反应恰好完全)。回答下列问题:

(1)白色粉末中一定没有的物质是_____________(填化学式,下同)。
(2)无色溶液1中一定含有的溶质___________,是可能含有的溶质是___________。
(3)生成无色气体的化学方程式为__________________________________;该反应属于____________(填反应基本类型).
(4)生成白色沉淀b的离子方程式为__________________________________ 。
【答案】CuSO4 NaNO3 KCl BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑ 复分解反应 Ba2++SO42-=BaSO4↓
【解析】
白色粉末加入水中,振荡,有白色沉淀a生成,过滤后溶液1呈无色,说明不含CuSO4;向沉淀a中加入足量稀硝酸,固体完全溶解,并有气泡产生,应为碳酸钡沉淀,说明含有Ba(NO3)2和Na2CO3,生成的气体为CO2;无色溶液2中滴入稀硫酸,有白色沉淀b产生,此沉淀为BaSO4,以此解答该题。
白色粉末加入水中,振荡,有白色沉淀a生成,过滤后溶液1呈无色,说明不含CuSO4;向沉淀a中加入足量稀硝酸,固体完全溶解,并有气泡产生,应为碳酸钡沉淀,说明含有Ba(NO3)2和Na2CO3,生成的气体为CO2;无色溶液2中滴入稀硫酸,有白色沉淀b产生,此沉淀为BaSO4,说明粉末中一定含有Ba(NO3)2和Na2CO3,一定没有CuSO4,可能有KCl;
(1)白色粉末中一定没有的物质是CuSO4;
(2) 粉末中一定含有Ba(NO3)2和Na2CO3,可能有KCl,则无色溶液1中一定含有的溶质是NaNO3,是可能含有的溶质是KCl;
(3)碳酸钡溶于稀硝酸生成CO2气体发生反应的化学方程式为BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑;该反应属于复分解反应;
(4)白色沉淀b为BaSO4,反应的离子方程式为Ba2++SO42-=BaSO4↓。


科目:高中化学 来源: 题型:
【题目】下列实验结论与实验现象相符合的一组是
选项 | 实验 | 现象 | 结论 |
A | 向某盐溶液中加入浓NaOH溶液,加热 | 产生的气体能使湿润的红色石蕊试纸变蓝 | 原溶液中含有 |
B | 把SO2通入紫色的酸性高锰酸钾溶液中 | 溶液紫色褪去 | SO2具有漂白性 |
C | 向蔗糖中滴加浓硫酸 | 蔗糖变黑 | 浓硫酸具有吸水性 |
D | 向盛有Cu片的试管中加入稀H2SO4,无明显现象,再加入NaNO3固体 | Cu片逐渐溶解,产生气 泡,溶液变蓝 | NaNO3是催化剂,可增大Cu与稀H2SO4反应的化学反应速率 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2N2O5(g) → 4NO2(g) + O2(g), R.A.Ogg提出如下反应历程:
第一步:2N2O5 ![]() NO2 +NO3 快速平衡;
NO2 +NO3 快速平衡;
第二步:NO2 +NO3 →NO2 +NO+ O2 慢反应;
第三步:NO+ NO3 →2NO2 快反应;其中可近似认为第二步反应不影响第一步平衡。下列表述正确的是
A.υ逆(第一步) < υ正(第二步)B.反应的中间产物只有NO
C.第二步中NO2 和NO3 碰撞部分有效D.第三步正反应的活化能较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列电解质溶液的说法中,正确的是
A.常温下,![]() 与
与![]() 两溶液混合后
两溶液混合后![]() ,则一定有
,则一定有![]()
B.常温下,![]() 溶液与
溶液与![]() 溶液混合后所得
溶液混合后所得![]() 的溶液中:
的溶液中:![]()
C.![]() 溶液中离子总数为x,
溶液中离子总数为x,![]() 溶液中离子总数为y,则
溶液中离子总数为y,则![]()
D.已知:![]() 的
的![]() 为
为![]() ,若将浓度均为
,若将浓度均为![]() 的
的![]() 溶液和KOH溶液等体积混合,则会有
溶液和KOH溶液等体积混合,则会有![]() 沉淀产生
沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组研究SO2与Na2O2的反应。
(1)实验前分析物质的化学性质,提出假设:
假设1:SO2和CO2都是酸性氧化物。类比CO2与Na2O2的反应可知,SO2与Na2O2反应生成Na2SO3和O2;
假设2:SO2具有______性,SO2与Na2O2反应生成Na2SO4。
(2)用下图所示装置进行SO2与Na2O2反应的实验。实验过程中,观察到C中淡黄色粉末逐渐变为白色,用带火星的木条靠近D中导气管口,木条复燃。

①A中反应产生SO2的化学方程式是______。
②B中的试剂为______,其主要作用是干燥SO2。
③能证明假设1成立的实验现象是______。
(3)为检验C中是否有Na2SO4生成,设计如下方案:
取少量C中反应后的白色固体溶解于水,加入BaCl2溶液,产生白色沉淀,再加入足量的稀HNO3,仍有白色沉淀不溶解,证明有Na2SO4生成。
该方案是否合理?______(填“合理”或“不合理”)。请简要说明理由:______。
(4)进一步实验证明C中反应后的固体中既有Na2SO3又有Na2SO4。从氧化还原反应的角度分析,+4价硫元素能被氧化为+6价。在上述实验条件下,+4价硫元素未完全转化为+6价,可见化学反应实际进行的情况与反应的______(只写一条)有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,石灰乳达到平衡:Ca(OH)2 (s)![]() Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
A.加水,Ca(OH)2 溶解平衡向右移动,pH 增大
B.加入少量盐酸,Ca(OH)2 溶解平衡向右移动,ksp﹝Ca(OH)2﹞增大
C.加入少量氢氧化钠固体,Ca(OH)2 溶解平衡向左移动,溶液中 c(H+)减小
D.升高温度,Ca(OH)2 溶解平衡向右移动,ksp﹝Ca(OH)2﹞增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如图:

(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的离子方程式是_________________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
ⅰ:2Fe2++PbO2+4H++SO![]() ===2Fe3++PbSO4+2H2O
===2Fe3++PbSO4+2H2O
ⅱ:……
①写出ⅱ的离子方程式:_______________________________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b._________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )

A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为_____________________。
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
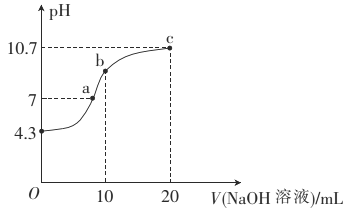
①写出H2N2O2在水溶液中的电离方程式:______________。
②b点时溶液中c(H2N2O2)_____(填“>”、“<”或 “=”,下同)c(N2O22-)。
③a点时溶液中c(Na+)____c(HN2O2-)+c(N2O22-)。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中![]() =______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com