
【题目】研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
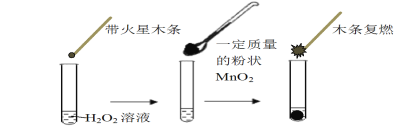
(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂,写出该反应的化学方程式 。
(2)为探究MnO2的质量对催化效果的影响,乙同学分别量取50 mL 1% H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如下:
MnO2的质量/g | 0.1 | 0.2 | 0.4 |
40s末O2体积/mL | 49 | 61 | 86 |
由此得出的结论是 。
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10 mL 5% H2O2 ) :
试管 | Ⅰ | Ⅱ | Ⅲ |
滴加试剂 | 5滴0.1 mol·L-1 FeCl3 | 5滴0.1 mol·L-1 CuCl2 | 5滴0.3 mol·L-1 NaCl |
产生气 泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
结论是 ,实验Ⅲ的目的是 。
(4)查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和 。
【答案】(1)2H2O2=2H2O+O2 ↑
(2)在一定质量范围内,增加MnO2的质量,化学反应速率加快
(3)Fe3+和Cu2+对H2O2分解均有催化效果,且Fe3+比Cu2+催化效果好
对比实验,说明Cl-对的H2O2分解没有催化效果
(4)2FeCl2+ H2O2+2HCl=2FeCl3+2H2O
【解析】
试题分析:(1)过氧化氢分解生成水和氧气,方程式为2H2O2![]() 2H2O+O2↑;(2)根据测得的数据,在一定质量范围内,增加MnO2的质量,化学反应速率加快;(3)根据表格数据,Fe3+和Cu2+对H2O2分解均有催化效果,且Fe3+比Cu2+催化效果好;实验Ⅲ的目的是对比实验,说明Cl-对的H2O2分解没有催化效果;(4)催化剂在反应前后质量不变,2FeCl3 + H2O2 = 2FeCl2 + O2↑+ 2HCl反应消耗FeCl3,在另一个反应中生成FeCl3,方程式为2FeCl2+ H2O2+2HCl=2FeCl3+2H2O。
2H2O+O2↑;(2)根据测得的数据,在一定质量范围内,增加MnO2的质量,化学反应速率加快;(3)根据表格数据,Fe3+和Cu2+对H2O2分解均有催化效果,且Fe3+比Cu2+催化效果好;实验Ⅲ的目的是对比实验,说明Cl-对的H2O2分解没有催化效果;(4)催化剂在反应前后质量不变,2FeCl3 + H2O2 = 2FeCl2 + O2↑+ 2HCl反应消耗FeCl3,在另一个反应中生成FeCl3,方程式为2FeCl2+ H2O2+2HCl=2FeCl3+2H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:
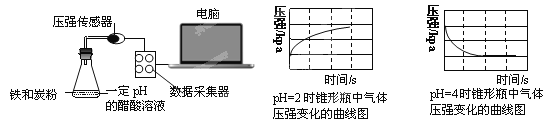
分析图像,以下结论错误的是
A.溶液pH≤2时,生铁发生析氢腐蚀
B.生铁的腐蚀中化学腐蚀比电化学腐蚀更普遍
C.在酸性溶液中生铁可能发生吸氧腐蚀
D.两溶液中负极反应均为:Fe – 2e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① | |||||||
2 | ⑤ | ⑥ | ⑦ | |||||
3 | ② | ③ | ④ | ⑧ | ||||
4 | ⑨ | |||||||
5 | ⑩ |
(1)元素⑥的名称为 ;⑨的最高价含氧酸的化学式为 。
(2)①和⑦两种元素的原子按1:1组成的常见化合物的结构式为 。
(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为 。(用离子符号表示)
(4)②、④的最高价氧化物的水化物之间发生反应的离子方程式 。
(5)用电子式表示③和⑨组成的化合物的形成过程 。
(6)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质。写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究金属腐蚀的条件和速率,某课外小组学生用金属丝将三根大小相同的铁钉分别固定在图示的三个装置中,再放置于玻璃钟罩里保存相同的一段时间。下列对实验结束时现象的描述不正确的是( )
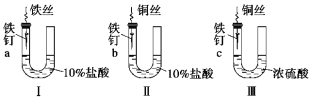
A.装置Ⅰ左侧的液面一定会下降 B.左侧液面装置Ⅰ比装置Ⅱ的低
C.装置Ⅱ中的铁钉腐蚀最严重 D.装置Ⅲ中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列操作中,一般情况下不能相互接触的是( )
A. 用胶头滴管向试管内滴加液体时,胶头滴管尖端与试管内壁
B. 分液时,分液漏斗下端与烧杯内壁
C. 过滤时,烧杯内壁与漏斗下端
D. 过滤时,玻璃棒与三层滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.在分子中,两个成键的原子间的距离叫做键长
B.H—Cl的键能为431.8 kJ/mol,H—I的键能为298.7 kJ/mol,这可以说明HCl分子比HI分子稳定
C.含有极性键的分子一定是极性分子
D.键能越大,表示该分子越容易受热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是( )
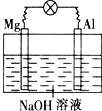
A.镁比铝活泼,镁失去电子被氧化成Mg2+
B.铝是电池负极,开始工作时溶液中会立即有白色沉淀生成
C.该装置的内、外电路中,均是电子的定向移动形成电流
D.该装置开始工作时,铝片表面的氧化膜可不必处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2014大纲卷)A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是 ,写出一种工业制备单质F的离子方程式 。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为 ,其水溶液与F单质反应的化学方程式为 ;在产物中加入少
量KI,反应后加人CC14并振荡,有 机层显 色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A的二元离子化合物 |
b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
c | 化学组成为BDF2 |
d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为 ;b的化学式为 ;;c的电子式为 ;
d的晶体类型是 。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过 键构
成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com