
【题目】(2014大纲卷)A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是 ,写出一种工业制备单质F的离子方程式 。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为 ,其水溶液与F单质反应的化学方程式为 ;在产物中加入少
量KI,反应后加人CC14并振荡,有 机层显 色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A的二元离子化合物 |
b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
c | 化学组成为BDF2 |
d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为 ;b的化学式为 ;;c的电子式为 ;
d的晶体类型是 。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过 键构
成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为 。
【答案】
(1)第一周期IA族 2Cl- +2H2O![]() 2OH- +H2↑+C12↑(或2NaCl(熔融)
2OH- +H2↑+C12↑(或2NaCl(熔融) ![]() 2Na+Cl2。↑
2Na+Cl2。↑
(2)纯碱(或苏打) 2Na2CO3+Cl2+H2O = NaClO+NaCl+2NaHCO3 紫
(3)NaH Na2O2和Na2C2 ![]() 金属晶体
金属晶体
(4)氢 正四面体
【解析】解题时要根据信息推导出所有元素,并根据这些元素应用元素周期律、元素及其化合物知识分析回答相关问题。根据“非金属元素A最外层电子数与其周期数相同”确定A为氢元素,然后根据其它信息推出B为碳元素,D为氧元素,E为钠元素,F为氯元素。
(1)H在周期表中的位置为第一周期IA族;工业制备上Cl2的原理有电解饱和食盐水或电解熔融的NaCl,据此便可写出其相应的离子方程式。
(2)C、O、Na组成的一种盐中,满足E的质量分数为43%的盐为Na2CO3,俗称纯碱或苏打;其水溶液与Cl2反应,可理解为Cl2先与水反应有HCl和HClO,Na2CO3水解有NaHCO3和NaOH,二者再反应,可确定其生成物有NaClO 、NaCl 、NaHCO3,然后通过氧化还原反应的配平方法将其配平;在产物中加入少量KI,NaClO将KI氧化生成I2,反应后加人CC14并振荡溶液显紫色。
(3)在这些元素中只有Na才与H形成二元离子化合物NaH(a的化学式);形成含有非极性共价键的二元离子化合物,且原子数之比为1:1的物质有Na2〇2和Na2C2(b的化学式);BDF2的化学式为COCl2,其结构式为![]() ,据此便可写出其电子式
,据此便可写出其电子式![]() ;只存在一种类型作用力且可导电的单质晶体为金属钠,属于金属晶体。
;只存在一种类型作用力且可导电的单质晶体为金属钠,属于金属晶体。
(4) 由H和C、O元素组成的两种二元化合物CH4、H2O能形成一类新能源物质,一种化合物分子(H2O)通过氢键构成具有空腔的固体;另一种化合物(沼气的主要成分CH4)分子进入该空腔,CH4分子的空间结构为正四面体结构。


科目:高中化学 来源: 题型:
【题目】研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
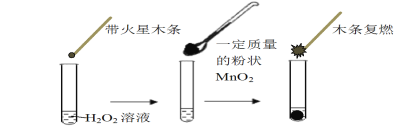
(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂,写出该反应的化学方程式 。
(2)为探究MnO2的质量对催化效果的影响,乙同学分别量取50 mL 1% H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如下:
MnO2的质量/g | 0.1 | 0.2 | 0.4 |
40s末O2体积/mL | 49 | 61 | 86 |
由此得出的结论是 。
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10 mL 5% H2O2 ) :
试管 | Ⅰ | Ⅱ | Ⅲ |
滴加试剂 | 5滴0.1 mol·L-1 FeCl3 | 5滴0.1 mol·L-1 CuCl2 | 5滴0.3 mol·L-1 NaCl |
产生气 泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
结论是 ,实验Ⅲ的目的是 。
(4)查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明化学反应有一定的限度,进行了如下探究活动:
步骤1:取8mL0.1![]() 的KI溶液于试管,滴加0.1
的KI溶液于试管,滴加0.1![]() 的FeCl3溶液5~6滴,振荡;
的FeCl3溶液5~6滴,振荡;
请写出步骤1中发生的离子反应方程式:_________________
步骤2:在上述试管中加入2mLCCl4,充分振荡、静置;
步骤3:取上述步骤2静置分层后的上层水溶液少量于试管,滴加0.1![]() 的KSCN溶液5~6滴,振荡,未见溶液呈血红色。
的KSCN溶液5~6滴,振荡,未见溶液呈血红色。
探究的目的是通过检验Fe3+,来验证是否有Fe3+残留,从而证明化学反应有一定的限度。针对实验现象,同学们提出了下列两种猜想:
猜想一:KI溶液过量,Fe3+完全转化为Fe2+,溶液无Fe3+
猜想二:Fe3+大部分转化为Fe2+,使生成Fe(SCN)3浓度极小,肉眼无法观察其颜色为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚比水轻且微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大。
信息二:Fe3+可与![]() 反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
结合新信息,请你完成以下实验:各取少许步骤2静置分层后的上层水溶液于试管A、B中,请将相关的实验操作、预期现象和结论填入下表空白处:
实验操作 | 预期现象 | 结论 |
实验1:在试管A加入少量乙醚,充分振荡,静置 | _________________ | ________________ |
实验2:__________________________ __________________________________ | 若产生蓝色沉淀 | 则“猜想二”成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)( )
选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
A | NaCl(Na2CO3) | 稀硫酸 | 蒸发结晶 |
B | CO2(CO) | O2 | 点燃 |
C | Zn (Ag) | 稀盐酸 | 过滤 |
D | 自来水(Cl﹣) | ﹣﹣﹣ | 蒸馏 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A. 硫化亚铁溶于稀硝酸中:FeS+2H+===Fe2++H2S↑
B. NH4HCO3溶于过量的NaOH溶液中:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
C. MnO2与浓盐酸反应制Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D. 大理石溶于醋酸中:CaCO3+2CH3COOH===Ca2++2CH3COO-+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)![]() 3Z(g)。此反应达到平衡的标志是( )
3Z(g)。此反应达到平衡的标志是( )
A. 容器内压强不随时间变化
B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为l:2:3
D. 单位时间消耗0.1molX同时生成0.3molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于分离或提纯物质的方法有:A.蒸馏(分馏) B.萃取C.过滤 D.重结晶 E.分液F.渗析.下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)
(1)除去Ca(OH)2溶液中悬浮的CaCO3微粒
(2)分离四氯化碳与水的混合物
(3)分离淀粉和NaCl溶液 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀硫酸酸化后的软锰矿(主要成分为MnO2)悬浊液可用于吸收燃煤尾气中的SO2,得到MnSO4, MnSO4可与KMnO4反应制备电池材料MnO2,同时生成H2SO4。下列用来解释事实的方程式不正确的是( )
A.MnO2吸收SO2的反应:![]()
B.MnO2作为碱性电池正极材料时的放电反应:![]()
C.MnSO4与KMnO4反应制备![]()
D.尾气中的SO2 还可用足量的氨水吸收:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图中包含的信息分析,下列叙述正确的是( )

A.氢气与氯气反应生成1mol氯化氢气体,反应吸收248kJ的能量
B.436kJ/mol是指断开1molH 2 中的H-H键需要放出436kJ的能量
C.431kJ/mol是指生成2molHCl中的H-Cl键需要放出431kJ的能量
D.氢气与氯气反应生成2mol氯化氢气体,反应放出183kJ的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com