
【题目】用于分离或提纯物质的方法有:A.蒸馏(分馏) B.萃取C.过滤 D.重结晶 E.分液F.渗析.下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填方法的标号)
(1)除去Ca(OH)2溶液中悬浮的CaCO3微粒
(2)分离四氯化碳与水的混合物
(3)分离淀粉和NaCl溶液 .
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.在分子中,两个成键的原子间的距离叫做键长
B.H—Cl的键能为431.8 kJ/mol,H—I的键能为298.7 kJ/mol,这可以说明HCl分子比HI分子稳定
C.含有极性键的分子一定是极性分子
D.键能越大,表示该分子越容易受热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某体积可变的密闭容器,盛有适量的A、B混合气体,在一定条件下发生反应A(g)+3B(g)![]() 2C(g)。若维持温度和压强不变,当反应达到限度时容器的体积为VL,其中C气体的体积分数占10%.下列推断正确的是( )
2C(g)。若维持温度和压强不变,当反应达到限度时容器的体积为VL,其中C气体的体积分数占10%.下列推断正确的是( )
A. 原混合气体的体积为1.1VL
B. 原混合气体的体积为1.2VL
C. 反应达到限度时,气体A消耗掉0.05 VL
D. 反应达到限度时,气体B消耗掉0.05 VL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2014大纲卷)A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是 ,写出一种工业制备单质F的离子方程式 。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为 ,其水溶液与F单质反应的化学方程式为 ;在产物中加入少
量KI,反应后加人CC14并振荡,有 机层显 色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A的二元离子化合物 |
b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
c | 化学组成为BDF2 |
d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为 ;b的化学式为 ;;c的电子式为 ;
d的晶体类型是 。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过 键构
成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 硫代硫酸钠与稀盐酸的反应Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O在加热条件下反应速度加快,原因主要是( )
A.该反应是吸热反应,加热使平衡向正向移动
B.加热促使SO2逸出,使平衡向正向移动
C.加热提高了活化的S2O![]() 与H+数目,并促进S2O
与H+数目,并促进S2O![]() 与H+的碰撞,使反应加速
与H+的碰撞,使反应加速
D.加热提高了活化的Na+与Cl-数目,并促进Na+与Cl-的碰撞,使反应加速
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 酸性氧化物均与水反应生成对应的酸
B. 将NaOH溶液逐滴加入FeCl3溶液可制备Fe(OH)3胶体
C. HF与SiO2反应,可用氢氟酸在玻璃器皿上刻蚀标记
D. 碱石灰、玻璃、生石灰、漂白粉都是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关除杂的实验操作合理的是
A. 用加入过量氨水并过滤的方法除去NaCl溶液中混有的AlCl3
B. 除去NaCl溶液中少量的Na2S:加入AgCl后再过滤
C. 向MgCl2溶液中加入CaCO3粉末,充分搅拌后过滤可除去杂质FeCl3
D. 除去FeCl3溶液中少量的CuCl2:加入足量铁粉,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的叙述,正确的是( )
A. 用浓氨水洗涤做过银镜反应的试管
B. 用分液漏斗分离环己烷和水的混合液体
C. 分馏石油时,温度计的末端必须插入液面下
D. 配制新制Cu(OH)2溶液时,在2mL10% CuSO4溶液中滴入几滴2%NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ·mol﹣1,甲醚可作燃料电池的燃料.
(1)写出甲醚燃烧的热化学方程式 ;已知H2(g)和C(s)的燃烧热分别是285.8kJ·mol﹣1、393.5kJ·mol﹣1;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热△H= kJ·mol﹣1;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)![]() CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是 (选填编号,注意大小写)。
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有1mol H2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
②温度升高,该化学平衡移动后,达到新的平衡,CH3OCH3的产率将 (填“变大”、“变小”或“不变”,下同)。
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式的其中一个产物是CO32﹣,请写出该反应的负极反应式 ;
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL NaCl溶液,装置如图所示,请写出电解过程中Y电极附近观察到的现象是 ;当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液中C(OH-)= mol/L(假设溶液的体积不变,气体全部从溶液中逸出).
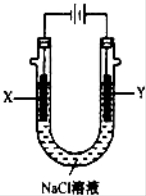
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com