
【题目】十氢奈是具有高储氢密度的氢能载体,经历“十氢奈(C10H18 )→四氢奈(C10H12)→奈(C10H8)”的脱氢过程释放氢气。已知:
C10H18(l)![]() C10H12(l)+3H2(g) △H1
C10H12(l)+3H2(g) △H1
C10H12(l)![]() C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
△H1>△H2>0;C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,十氢奈的常压沸点为192℃;在192℃,液态十氢奈的脱氢反应的平衡转化率约为9%。请回答:
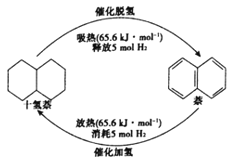
(1)每1mol 十氢萘液体可储存5mol氢气,可运载到使用氢气的场所,在催化剂的作用下释放氢气,生成的液体萘可重复催化加氢来储存氢气,如图所示,则△H1+△H2=__________。
(2)有利于提高上述反应平衡转化率的条件是__________。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)不同压力和温度下十氢萘的平衡转化率如图所示,结合图示回答问题:
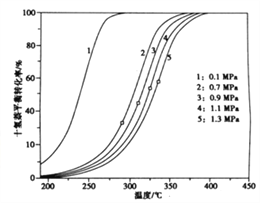
①在相同压强下升高温度,未达新平衡前,v正__________v逆(填写“大于”“小于”或“等于”)。
②研究表明,将适量的十氢奈置于恒容密闭反应器中,既升高温度又增大压强,十氢萘的转化率也升高,可能理由是______________________________________。
(4)温度335℃,在恒容密闭反应器中进行高压液态十氢奈(1.00 mol)催化脱氢实验,测得液态C10H12和液态C10H8的产率x1和x2(以物质的量分数计)随时间变化关系,如图所示。
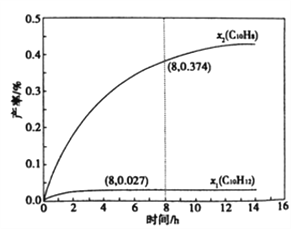
①在8h时,反应体系内氢气的量为_______mol(忽略其他副反应),液态十氢奈的转化率是____。
②x1显著低于x2的原因是_______________________________________________。
【答案】 65.6kJ·mol-1 C 大于 升高温度正向移动的程度大于加压逆向移动的程度 1.95 40.1% 四氢萘转化为萘的活化能小,反应速率很快,生成的四氢萘大部分转化为萘,因此x1显著低于x2
【解析】(1)根据盖斯定律,已知中的两个反应热化学方程式相加得:C10H18(l)![]() C10H8(l)+5H2(g) △H1+△H2,由图可得:△H1+△H2=65.6kJ·mol-1。
C10H8(l)+5H2(g) △H1+△H2,由图可得:△H1+△H2=65.6kJ·mol-1。
(2)由上面的分析可得,该反应是吸热反应,且生成物气体分子数增大,所以高温低压有利于提高平衡转化率,故选C。
(3)①由图像可得,在相同压强下升高温度,十氢萘的平衡转化率增大,则未达新平衡前,v正>v逆。②升高温度有利于该反应正向移动,增大压强有利于该反应逆向移动,将适量的十氢奈置于恒容密闭反应器中,既升高温度又增大压强,十氢萘的转化率也升高,可能是升高温度正向移动的程度大于增大压强逆向移动的程度。
(4)①温度335℃,在恒容密闭反应器中进行高压液态十氢奈催化脱氢实验,十氢萘(C10H18)初始为1.00 mol,如图所示,在8 h时测得C10H12和C10H8的产率x1=0.027,x2=0.374,即生成C10H12和C10H8的物质的量分别为0.027mol、0.374mol,设反应的C10H18的物质的量为n1,反应的C10H12的物质的量为n2,根据反应关系:

则n1-n2=0.027mol,n2=0.374mol,所以n1=0.401mol,因此生成的氢气的物质的量为:3n1+2n2=3×0.401mol+2×0.374mol=1.951mol≈1.95mol;十氢萘(C10H18)的转化率为: ![]() ×100%=
×100%=![]() ×100%=40.1%。②因为△H1>△H2>0,C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,所以Ea1>Ea2,即四氢萘转化为萘的活化能小,相同温度下反应速率更快,所以相同时间内,生成的四氢萘大部分都转化为萘,故x1显著低于x2。
×100%=40.1%。②因为△H1>△H2>0,C10H18→C10H12的活化能为Ea1,C10H12→C10H8的活化能为Ea2,所以Ea1>Ea2,即四氢萘转化为萘的活化能小,相同温度下反应速率更快,所以相同时间内,生成的四氢萘大部分都转化为萘,故x1显著低于x2。


科目:高中化学 来源: 题型:
【题目】有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是________,一定不含有的物质是________,可能含有的物质是________(以上空格均填写化学式)。对可能含有的物质,可采用向滤液中滴加___________________溶液的方法来检验。
(2)写出步骤③中的离子方程式__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化反应与还原反应在同一元素中进行的是( )
A. Cl2+2NaOH=NaCl+NaClO+H2O
B. Fe+CuSO4=FeSO4+Cu
C. 2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D. 2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L NaOH溶液滴定 20.00mL 0.1000 mol/L
CH3COOH溶液滴定曲线如右图。下列说法正确的是

A. 点①所示溶液中:c(CH3COO-)+ c(OH-) =c(CH3COOH)+ c(H+)
B. 点②所示溶液中:c(Na+) =c(CH3COOH)+ c(CH3COO-)
C. 点③所示溶液中:c(Na+)> c(OH-)> c(CH3COO-)> c(H+)
D. 滴定过程中可能出现:c(CH3COOH)> c(CH3COO-)> c(H+)> c(Na+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 苯与浓硝酸、浓硫酸共热并保持 70~80 ℃反应生成硝基苯
B. 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于苯环对侧链的影响,使侧链易被氧化
C. 若甲苯苯环上的一个氢原子被一个含 3 个碳原子的烷基取代,所得产物有 6 种
D. 菲的结构简式为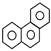 ,它与硝酸反应,可生成 5 种一硝基取代物
,它与硝酸反应,可生成 5 种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
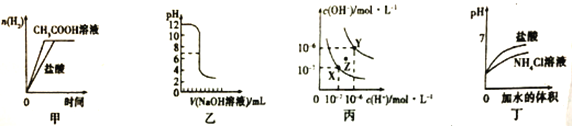
A. 甲图曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中分别加入足量镁粉产生H2的物质的量的变化
B. 乙图表示将0.01mol/L的NaOH溶液滴入到稀盐酸中的滴定曲线
C. 丙图为水的电离曲线,从Z点到X点,可采用在水中加入适量NaOH固体的方法
D. 丁图中曲线表示将pH相同的NH4Cl溶液和盐酸稀释相同倍数时,二者pH的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】格林尼亚试剂简称“格氏试剂”,是有机卤化物与金属镁在无水乙醚或四氢呋喃(THF)中反应制得,在有机合成中用途广泛。反应原理如下:
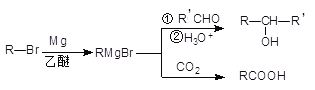
由A( ![]() )合成 I (
)合成 I ( ![]() )的流程图:
)的流程图:
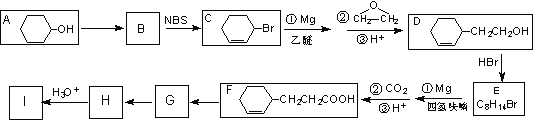
(已知:NBS为溴化试剂,在一定条件下能与烯烃作用生成溴代烯烃。)
(1) 物质A的名称为_________________;由A生成B的反应类型是_________;
(2) 写出由A制备 ![]() 的化学方程式_________________________;
的化学方程式_________________________;
(3) 四氢呋喃是一种优良的溶剂,可由呋喃( ![]() )加氢得到,则四氢呋喃的结构简式为_____________________;
)加氢得到,则四氢呋喃的结构简式为_____________________;
(4) 写出由G生成H的化学方程式_____________________________________;
(5) 写出符合下列要求的I的同分异构体的结构简式_____________________;(写出一种即可,同一碳上不能连接2个羟基)
① 芳香族化合物 ② 二元醇 ③ 分子中有5种化学环境的H
(6) 参照上述信息,以A和A制得的环己酮( ![]() )为原料合成
)为原料合成![]() (
(![]() )______________________。
)______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸碱完全中和时
A. 酸和碱的物质的量一定相等
B. 酸所提供的H+与碱提供的OH-的物质的量相等
C. 酸和碱的物质的量浓度相等
D. 溶液一定呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com