
【题目】现有A、B、C、D四种气体,A是密度最小的气体,B在通常情况下呈黄绿色,把四种气体分别通入酸性硝酸银溶液中,通入B、D气体时立即出现白色沉淀,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D。把无色无刺激气味气体C通入澄清石灰水时变浑浊。
(1)A、B、C、D的化学式分别为:
A_______;B______;C______;D_____。
(2)写出下列各反应的化学方程式:
A与B_______;
B与水_______。
【答案】H2 Cl2 CO2 HCl 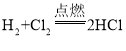 Cl2+H2O=HCl+HClO
Cl2+H2O=HCl+HClO
【解析】
A是密度最小的气体即为氢气,B在通常情况下呈黄绿色即为氯气,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D即氢气和氯气反应生成氯化氢气体的特征现象,即D为氯化氢,把四种气体分别通入酸性硝酸银溶液中,通入B、D气体时立即出现白色沉淀,进一步验证B为氯气,D为氯化氢,无色无刺激气味气体C通入澄清石灰水时变浑浊即为二氧化碳气体。
⑴A是密度最小的气体即为氢气,A为H2;
B在通常情况下呈黄绿色即为氯气,B为Cl2;
无色无刺激气味气体C通入澄清石灰水时变浑浊即为二氧化碳气体,C为CO2;
纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D即生成HCl,D为HCl;
⑵A与B反应方程式为: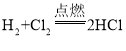 ;
;
B与水反应方程式为:Cl2+H2O=HCl+HClO。


科目:高中化学 来源: 题型:
【题目】磷精矿湿法制备磷酸的一种工艺流程如下:

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
(1)上述流程中能加快反应速率的措施有__________。
(2)磷精矿粉酸浸时发生反应:
2Ca5(PO4)3(OH)+3H2O+10H2SO4![]() 10CaSO4·0.5H2O+6H3PO4
10CaSO4·0.5H2O+6H3PO4
①该反应体现出酸性关系:H3PO4__________H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,__________。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:__________。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:____________________。

(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42残留,原因是__________;加入BaCO3可进一步提高硫的脱除率,其离子方程式是____________________。
(6)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L1NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c mL,精制磷酸中H3PO4的质量分数是________。(已知:H3PO4摩尔质量为98 g·mol1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置制取并收集气体,对应的装置和试剂均正确的是( )

Ⅲ收集气体 | Ⅰ中试剂a,b | Ⅱ中试剂c | Ⅳ中试剂d | |
A | SO2 | 稀硫酸与铜片 | 浓硫酸 | NaOH溶液 |
B | Cl2 | 浓盐酸与二氧化锰 | 饱和氯化钠溶液 | NaOH 溶液 |
C | HBr | 浓硫酸与溴化钠 | 浓硫酸 | 水 |
D | CO | 甲酸与浓硫酸 | 浓硫酸 | 酸性KMnO4溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三个反应:
反应① Fe(s)+H2O(g)![]() FeO(s)+H2(g) △H1 平衡常数为K1
FeO(s)+H2(g) △H1 平衡常数为K1
反应② CO(g)+H2O(g)![]() H2(g)+CO2(g) △H2 平衡常数为K2
H2(g)+CO2(g) △H2 平衡常数为K2
反应③ Fe(s)+CO2 (g)![]() FeO(s)+CO(g) △H3 平衡常数为K3
FeO(s)+CO(g) △H3 平衡常数为K3
在不同温度下,部分K1、K2的值如下:
T/℃ | 700 | 800 |
K1 | 2.38 | 2.56 |
K2 | 0.80 |
(1)K1的表达式为________;根据反应①、②、③推导出K1、K2、K3的关系式K3=______。
(2)要使反应①在一定条件下建立的平衡右移,可采取的措施有_________。(填字母)
A.缩小容器体积 B.降低温度 C.升高温度
D.使用合适的催化剂 E.设法减少H2的量 F.设法减少FeO的量
(3)800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应②,反应过程中测定的部分数据见下表:
反应时间/min | 0 | 2 | 4 | 6 |
n(CO)/mol | 1.20 | 0.90 | 0.80 | |
n(H2O)/ mol | 0.60 | 0.20 |
①反应在2 min内的平均速率为v(H2O)=________________;
②800℃时,K2的值为_______________;
③保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率_______________(填“增大”或“减小”或“不变”)。
(4)由以上信息推断反应③正反应方向为________(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴的某些化合物与铁的化合物性质相似,某研究性学习小组为探究钴的化合物的性质,进行了以下实验:
Ⅰ探究草酸钴的热分解产物
(1)为探究草酸钴的热分解产物,按气体流动方向,各装置的连接顺序为:A→E→_____。

(2)能验证分解产物中有CO的实验现象是_____。
(3)取3.66g CoC2O42H2O于硬质玻璃管中加热至恒重,冷却、称量,剩余固体的质量为1.5g,球形干燥管增重0.88g。则A中发生的反应方程式为_____。
Ⅱ探究Co(OH)2的还原性及Co(OH)3的氧化性
取A装置所得固体溶解于稀H2SO4中得到粉红色溶液,备用。
已知试剂颜色:CoSO4溶液(粉红色),Co(OH)2(粉红色),Co(OH)3(棕褐色)。
实验记录如下表:
实验操作及现象 | 实验分析 | |
实验1 | 取少许粉红色溶液于试管中,滴加0.1moL﹣1NaOH溶液,生成粉红色沉淀并将该沉淀分成两份 | |
实验2 | 取一份实验1中所得的粉红色沉淀,加入3%的H2O2溶液,粉红色沉淀立即变为棕褐色。 | 反应的化学方程式为①_____ |
实验3 | 向实验2得到的棕褐色沉淀中滴加浓盐酸固体逐渐溶解,并有黄绿色气体产生。 | 反应的离子方程式为②_____ |
实验4 | 取另一份实验1中所得的粉红色沉淀滴加浓盐酸,粉红色沉淀溶解,未见气体生成。 | 酸性条件下,Cl2、Co(OH)2、Co(OH)3的氧化能力由大到小的顺序是③________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应:X(g)+3Y(g) ![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol ·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol ·L-1,则下列判断正确的是( )
A. c1∶c2=1∶3
B. 平衡时Y和Z的生成速率之比为2∶3
C. X、Y的转化率之比为1:3
D. c1的取值范围为0.04 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌原电池装置(见图),下列分析正确的是( )

A. 一段时间后两烧杯中c(Zn2+)、c(Cu2+)均减小
B. 原电池工作时,Cu电极流出电子,发生反应:Cu-2e-===Cu2+
C. 原电池工作时,Zn电极发生还原反应:Zn2++2e-===Zn
D. 原电池工作时的总反应为Zn+Cu2+===Zn2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,A元素的原子得两个电子,B元素的原子失去1个电子后所形成微粒均与氩原子有相同的电子层结构。C元素的原子只有1个电子,D元素原子的M电子层数比N层电子数多6个。试写出:
(1)A、B、C、D的元素符号和名称:A____ B____C____D____。
(2)A元素的原子结构示意图____,D元素的离子结构示意图:______。
(3)画出A离子的电子式____B原子的电子式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用有机含碘(主要以I2和IO3-的形式存在)废水制备单质碘的实验流程如下:

已知:Ⅰ.碘的熔点为113 ℃,但固态的碘可以不经过熔化直接升华;
Ⅱ.粗碘中含有少量的Na2SO4杂质。
下列说法正确的是
A. 操作①和③中的有机相从分液漏斗上端倒出
B. 操作②中发生反应的离子方程式为IO3-+3SO32-===I-+3SO42-
C. 操作④为过滤
D. 操作⑤可用如图所示的水浴装置进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com