
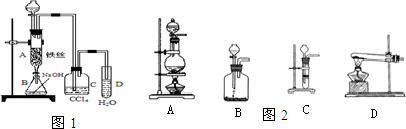
(15分)(1)某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。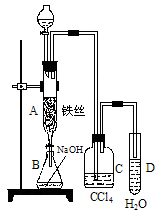
①写出A中有机反应的化学方程式 。
②已知上述有机反应是放热反应,观察到A中的现象是:
及_____ _________。
③ 实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是 ,写出有关的化学方程式 。
④C中盛放CCl4的作用是 。
⑤能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中滴入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入______ _____,现象是______________________。
(2)乙炔的实验室制法
①反应原理_____ ____________。
②选择合适的制取实验装置___ ___。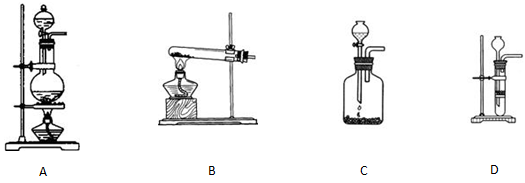
③实验中常用饱和食盐水代替水,目的是______ __________。
④纯净的乙炔气体是无色无味的气体,用电石和水反应制取的乙炔,常含有H2S和PH3而有恶臭气味。可以用____ _______溶液除去杂质气体。
(15分)(1)
① 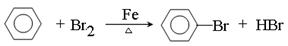
 (2)① CaC2+2H2O C2H2↑+Ca(OH)2 ② C
(2)① CaC2+2H2O C2H2↑+Ca(OH)2 ② C 解析试题分析:(1)①根据装置可知,A是制取溴苯的,反应的方程式是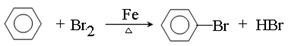 。
。
②由于反应是放热反应,而单质溴是易挥发的,所以观察到的实验现象是反应液微沸和有红棕色气体充满A容器。
③由于生成的溴苯中含有单质溴,所以实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是除去溶于溴苯中的溴,反应的方程式是Br2+2NaOH =NaBr+NaBrO+H2O。
④由于单质溴也能和硝酸银溶液反应生成白色沉淀,从而干扰溴化氢的检验,所以C中盛放CCl4的作用是除去溴化氢气体中的溴蒸气。
⑤然后是加成反应,则反应中就不会生成溴化氢,因此D中溶液不可能显酸性,据此可以鉴别。即加入石蕊试液,溶液变红色。
(2)①实验室制取乙炔是利用电石和水反应制取的,方程式是
CaC2+2H2O C2H2↑+Ca(OH)2。
C2H2↑+Ca(OH)2。
②由于反应不能加热,所以选项A和B都是错误的。电石溶于水即粉碎,所以不能用启普发生器,答案选C。
③由于电石和水的反应很剧烈,所以实验中常用饱和食盐水代替水,目的减缓电石与水的反应速率。
④H2S和PH3都能和硫酸铜溶液反应,因此可以用硫酸铜溶液除去该杂质气体。
考点:考查溴苯、乙炔的制取以及物质的除杂等。
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。纵观近几年高考,主要以考察探究性实验和物质制备实验为主。这些探究性和制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,要求考生必须冷静的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能正确作答。
探究性实验的一般思路:
1、准确地把握实验目的。
2、利用已学知识,分析如何实现这个目的--实验原理。
3、结合实验材料,初步确定设计对策--实验方案。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| Fe |
| Fe |
查看答案和解析>>
科目:高中化学 来源:2014届陕西省岐山县高三上学期期中质量检测化学试卷(解析版) 题型:填空题
(1)某化学课外小组用海带为原料制取少量碘水,现在用四氯化碳在碘水中萃取碘单质,并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗敖在铁架台的铁圈中:
B.把50mL碘水和15mL四氯化碳加入分液漏斗中,并盖好玻璃塞:
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞:
E.放开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽(或小孔)对准漏斗口上的小孔:
H.静置、分层。就此实验,完成下列填空:
正确操作步骤的顺序是: 。
(2)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发如下反应:Mn2++S2O82‾+H2O—MnO4‾+SO42‾+H+
该反应常用于检验Mn2+的存在。其特征现象是 。
若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
(3)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应: NaBiO3+ MnSO4+ H2SO4— Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
①配平上述反应的化学方程式,并标出电子转移的方向和数目:
②上述反应中还原产物是
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
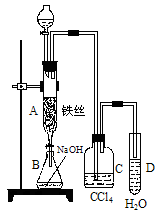
①写出A中有机反应的化学方程式
___________________________________________________
②已知上述有机反应是放热反应。观察到A中的现象是
_____________________及______________________。
③ 实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_______________________________________________,写出有关的化学方程式____________________________________________。
④C中盛放CCl4的作用是______________________________________。
⑤能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中滴入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入__________________,现象是___________________________________________。
(2)乙炔的实验室制法
①反应原理___________________________________________________。
②选择合适的制取实验装置_______。
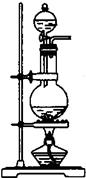

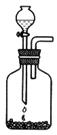 |  | ||
A B C D
③实验中常用饱和食盐水代替水,目的是___________________________________。
④纯净的乙炔气体是无色无味的气体,用电石和水反应制取的乙炔,常含有H2S和PH3而有恶臭气味。可以用________________溶液除去杂质气体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com