
【题目】铜是人类最早发现并广泛使用的一种金属。回答下列问题:
(1)CuFeS2是其中铜的主要存在形式。CuFeS2中存在的化学键类型是__。铜原子核外电子排布式为___。
(2)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是__,中心原子杂化类型为__。
②X的沸点比水低的主要原因是__。
(3)[Cu(NH3)4]2+中,提供孤对电子的是__。Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是__(填“极性”或“非极性”)分子,由此推知[Cu(NH3)4]2+的空间构型是__。
(4)某镍白铜合金的立方晶胞结构如图所示。
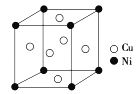
①晶胞中铜原子与镍原子的数量比为__。
②若合金的密度为dg·cm-3,晶胞边长a=__nm。(设NA代表阿伏加德罗常数)
【答案】离子键 1s22s22p63s23p63d104s1 V形 sp3 水分子间存在氢键 NH3 极性 平面正方形 3∶1 ![]() ×107
×107
【解析】
根据CuFeS2中元素构成,可判断化学键类型,Cu是29号元素,可写出它的核外电子排布式;根据H2S中中心原子硫的价层电子对数,由VSEPR判断其空间构型和杂化类型;根据水分子间能形成氢键,则沸点高;根据配位键形成的实质,判断谁提供了孤对电子;根据[Cu(NH3)4]2+中的两个NH3被两个Cl取代,能得到两种不同结构的产物,判断其空间构型;根据相似相溶原理,判断分子的极性;由均摊法求出原子个数比,根据化学式和密度,求出晶胞的边长。
(1)CuFeS2中硫为非金属元素,铁和铜为金属元素,它们之间形成的化学键为离子键,Cu是29号元素,Cu原子核外电子排布式是1s22s22p63s23p63d104s1;答案为离子键,1s22s22p63s23p63d104s1。
(2)①CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X是H2S,H2S分子中S原子价层电子对数为4,VSEPR模型为四面体形。但S原子有2对孤电子对,孤电子对对成键电子对的排斥作用大于成键电子对之间的排斥作用,导致H2S分子的构型为V形,S原子价层电子对数的4,所以中心原子硫杂化类型为sp3杂化;答案为V形,sp3。
②H2S的沸点比水低的主要原因是水分子间形成氢键,而H2S分子之间只存在分子间作用力,答案为水分子间存在氢键。
(3)在[Cu(NH3)4]2+中,铜离子提供空轨道,氨气分子中的氮元素提供孤电子对;Cu(NH3)2Cl2的同分异构体可溶于水,根据相似相溶原理,水是极性分子,所以该分子为极性分子;既然存在两种同分异构体,所以[Cu(NH3)4]2+的空间构型是平面正方形,若是正面体空间构型,Cu(NH3)2Cl2的结构只有一种;答案为NH3;极性;平面正方形。
(4)①该晶胞中Ni原子个数=8×![]() =1,Cu原子个数=6×
=1,Cu原子个数=6×![]() =3,则铜原子与镍原子的数量比为3:1;答案为3:1。
=3,则铜原子与镍原子的数量比为3:1;答案为3:1。
②该晶胞的化学式为Cu3Ni,若合金的密度为dg/cm3,根据V=a3,则晶胞边长a=![]() =
=![]() =
=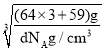 =
=![]() cm=
cm=![]() ×107nm,答案为
×107nm,答案为![]() ×107。
×107。


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】“笔、墨、纸、砚”在中国传统文化中被称为“文房四宝”,下列说法中错误的是( )
A | B | C | D |
|
|
|
|
用灼烧法可鉴别羊毫与尼龙毫的真伪 | 墨的主要成分是碳单质 | 纸的主要成分属于合成材料 | 用石材制作砚台的过程是物理变化 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是1mol金属镁和卤素反应的ΔH(单位:kJ·molˉ1)示意图,反应物和生成物均为常温时的稳定状态。下列选项中不正确的是
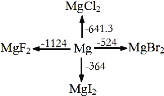
A.电解MgCl2制Mg是吸热反应
B.MgBr2与Cl2反应的ΔH<0
C.MgF2(s)+Br2(l) = MgBr2(s)+F2(g) ΔH=+600kJ·molˉ1
D.化合物的热稳定性顺序:MgI2>MgBr2>MgCl2>MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下三个热化学方程式:
H2(g)+![]() O2(g)=H2O(g) ΔH=akJ·mol-1
O2(g)=H2O(g) ΔH=akJ·mol-1
H2(g)+![]() O2(g)=H2O(l) ΔH=bkJ·mol-1
O2(g)=H2O(l) ΔH=bkJ·mol-1
2H2(g)+ O2(g)=2H2O(g) ΔH=ckJ·mol-1
下列相关表述正确的是( )
A.它们都是吸热反应B.a、b和c均为正值
C.a=bD.2a=c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2L恒容密闭容器中进行的某可逆反应 X(g)+2Y(g)![]() 2Z(g) 以c(Y)的改变表示的反应速度υ正(单位为mol·L-1·s-1),υ正、υ逆与时间的关系如图。则图中阴影部分的面积可表示( )
2Z(g) 以c(Y)的改变表示的反应速度υ正(单位为mol·L-1·s-1),υ正、υ逆与时间的关系如图。则图中阴影部分的面积可表示( )
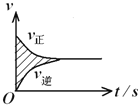
A.X的物质的量浓度的减少B.Y的物质的量浓度的减少
C.Z的物质的量增加D.Y的物质的量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷与氯气光照条件下取代反应的部分反应历程和能量变化如下:
第一步:![]()
第二步:![]()
第三步:![]() 中
中![]() 其中
其中![]() 表示氯原子,
表示氯原子,![]() 表示甲基
表示甲基![]() ,下列说法不正确的是( )
,下列说法不正确的是( )
A.由题可知,甲烷和氯气在室温暗处较难反应
B.![]()
C.形成![]() 中
中![]() 键放出的能量比拆开
键放出的能量比拆开![]() 中化学键吸收的能量多
中化学键吸收的能量多
D.若是甲烷与![]() 发生取代反应,则第二步反应
发生取代反应,则第二步反应![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把80mL NaOH溶液加入到120mL盐酸中,所得溶液的PH值为2,如果混合前NaOH溶液和盐酸的物质的量浓度相同,它们的浓度是_______________.
(2) 将pH=5的H2SO4溶液稀释500倍,稀释后溶液的c(H+)与c(SO42-)的比值近似为_________.
(3)25℃时,向纯水中加入NaOH,使溶液的pH=11,则由NaOH电离出的OH-离子浓度与水电离的OH-离子浓度之比为_____________.
(4)用0.1mol.L-1 NaOH溶液滴定0.lmol.L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL).继续加水至50mL,所得溶液的pH是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验目的与装置或仪器不一致的是 ( )
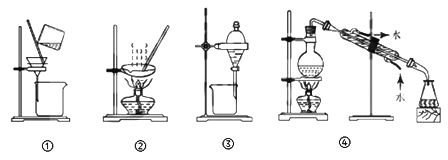
A. 粗盐提纯,选①和② B. 实验室制取蒸馏水,选④
C. 用CC14提取碘水中的碘,选③ D. 分离Na2CO3溶液和CH3COOC2H5,选①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 正反应的活化能比逆反应的活化能小a kJ·mol-1
D. 增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com