
【题目】(1)把80mL NaOH溶液加入到120mL盐酸中,所得溶液的PH值为2,如果混合前NaOH溶液和盐酸的物质的量浓度相同,它们的浓度是_______________.
(2) 将pH=5的H2SO4溶液稀释500倍,稀释后溶液的c(H+)与c(SO42-)的比值近似为_________.
(3)25℃时,向纯水中加入NaOH,使溶液的pH=11,则由NaOH电离出的OH-离子浓度与水电离的OH-离子浓度之比为_____________.
(4)用0.1mol.L-1 NaOH溶液滴定0.lmol.L-1盐酸,如达到滴定的终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05mL).继续加水至50mL,所得溶液的pH是_________
【答案】0.05 10:1 108:1 10
【解析】
(1)盐酸和氢氧化钠溶液混合后溶液显示碱性,说明氢氧化钠过量,设二者的物质的量浓度为c,然后计算出混合后溶液中氢氧根离子的物质的量浓度,根据溶液的pH=12可知,c(OH-)=![]() mol·L-1=1×10-2mol·L-1,据此计算出c.
mol·L-1=1×10-2mol·L-1,据此计算出c.
(2)由溶液pH=5,计算原溶液中c(H+),原溶液中c(SO42-)=![]() c(H+),稀释500倍,此时溶液接近中性,氢离子浓度不可能小于1×10-7mol·L-1,只能无限接近1×10-7mol·L-1,而稀释过程中硫酸根的物质的量不变,计算出稀释后溶液中硫酸根的物质的量浓度,最后得出比例关系。
c(H+),稀释500倍,此时溶液接近中性,氢离子浓度不可能小于1×10-7mol·L-1,只能无限接近1×10-7mol·L-1,而稀释过程中硫酸根的物质的量不变,计算出稀释后溶液中硫酸根的物质的量浓度,最后得出比例关系。
(3)根据H2O![]() H++OH-,从影响水的电离平衡移动的角度分析,NaOH抑制水的电离,根据溶液的PH为11,求出水电离出的c(H+),利用水的离子积常数求出氢氧化钠电离出的OH-离子浓度。
H++OH-,从影响水的电离平衡移动的角度分析,NaOH抑制水的电离,根据溶液的PH为11,求出水电离出的c(H+),利用水的离子积常数求出氢氧化钠电离出的OH-离子浓度。
(4)终点时不慎多加了1滴NaOH溶液,即0.05mL,继续加水至50mL,反应后溶液中c(OH-)=![]() ×0.1mol.L-1=10-4mol.L-1,根据c(H+)c(OH-)=10-14计算c(H+),进而计算所得溶液的pH。
×0.1mol.L-1=10-4mol.L-1,根据c(H+)c(OH-)=10-14计算c(H+),进而计算所得溶液的pH。
(1)混合前NaOH溶液和盐酸的物质的量浓度相同,所得溶液的pH为12,则溶液中氢氧根离子的浓度为:c(OH-)=![]() mol·L-1=1×10-2mol·L-1,设二者浓度为c,则混合后溶液中氢氧根离子的浓度为:c(OH-)=
mol·L-1=1×10-2mol·L-1,设二者浓度为c,则混合后溶液中氢氧根离子的浓度为:c(OH-)=![]() =1×10-2mol·L-1,解得:c=0.05mol·L-1;
=1×10-2mol·L-1,解得:c=0.05mol·L-1;
(2)pH为5的溶液中氢离子浓度为:c(H+)=1×10-5mol·L-1,硫酸根离子的浓度为:c(SO42-)=![]() c(H+)=
c(H+)=![]() ×1×10-5mol·L-1=5×10-6mol·L-1,溶液稀释500倍后,氢离子浓度不可能小于1×10-7mol·L-1,只能无限接近1×10-7mol·L-1,而硫酸根离子浓度为:c(SO42-)=5×10-6mol·L-1×
×1×10-5mol·L-1=5×10-6mol·L-1,溶液稀释500倍后,氢离子浓度不可能小于1×10-7mol·L-1,只能无限接近1×10-7mol·L-1,而硫酸根离子浓度为:c(SO42-)=5×10-6mol·L-1×![]() =1×10-8mol·L-1,所以稀释后溶液中c(H+)与c(SO42-)的比值近似为1×10-7mol·L-1:1×10-8mol·L-1=10:1;
=1×10-8mol·L-1,所以稀释后溶液中c(H+)与c(SO42-)的比值近似为1×10-7mol·L-1:1×10-8mol·L-1=10:1;
(3)pH=11的NaOH溶液,水电离的c(H+)=10-11mol·L-1,根据水的离子积常数由NaOH电离产生的c(OH-)=![]() mol·L-1=10-3mol·L-1,而由水电离产生的c
mol·L-1=10-3mol·L-1,而由水电离产生的c
(4)终点时不慎多加了1滴NaOH溶液,即0.05mL,继续加水至50mL,反应后溶液中c(OH-)=![]() ×0.1mol.L-1=10-4mol.L-1,根据c(H+)c(OH-)=10-14计算c(H+)10-10mol·L-1,pH=10。
×0.1mol.L-1=10-4mol.L-1,根据c(H+)c(OH-)=10-14计算c(H+)10-10mol·L-1,pH=10。


科目:高中化学 来源: 题型:
【题目】钠离子电池具有资源广泛、价格低廉、环境友好、安全可靠的特点,特别适合于固定式大规模储能应用的需求。一种以Na2SO4水溶液为电解液的钠离子电池总反应为:NaTi2(PO4)3 +2Na2NiFeII (CN)6 ![]() Na3Ti2(PO4)3 +2NaNiFeIII(CN)6(注:其中P的化合价为+5,Fe的上标II、III代表其价态)。下列说法不正确的是( )
Na3Ti2(PO4)3 +2NaNiFeIII(CN)6(注:其中P的化合价为+5,Fe的上标II、III代表其价态)。下列说法不正确的是( )
A.放电时NaTi2(PO4)3在正极发生还原反应
B.放电时负极材料中的Na+脱离电极进入溶液,同时溶液中的Na+嵌入到正极材料中
C.充电过程中阳极反应式为:2NaNiFeIII(CN)6+2Na++2e-=2Na2NiFeII (CN)6
D.该电池在较长时间的使用过程中电解质溶液中Na+的浓度基本保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PETG是一种新型材料,可回收利用,对环境不构成任何威胁,其结构简式如下: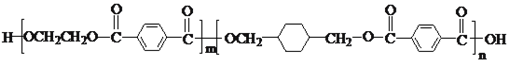 ,已知:RCOOR1+R2OH―→RCOOR2+R1OH(R、R1、R2表示烃基)。采用如下图所示的合成路线可合成PETG:
,已知:RCOOR1+R2OH―→RCOOR2+R1OH(R、R1、R2表示烃基)。采用如下图所示的合成路线可合成PETG:

试回答下列问题:
(1)试剂X为______________;反应⑦的反应类型为_______________。
(2)写出物质H的名称________________________。
(3)写出结构简式: I_____________________________。
(4)写出反应⑤的化学方程式:_________________________________________。
(5)合成时应控制的单体的物质的量n (D)∶n (F)∶n (H)=__________(用m、n表示)。
(6)同时符合下列要求的物质H的同分异构体共有__________种。
①遇FeCl3溶液显紫色;②能与NaHCO3溶液反应,并有气体放出;③能发生银镜反应。
(7)已知:![]() 请写出由D及其它必要物质可合成
请写出由D及其它必要物质可合成![]() 的反应历程。________________
的反应历程。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早发现并广泛使用的一种金属。回答下列问题:
(1)CuFeS2是其中铜的主要存在形式。CuFeS2中存在的化学键类型是__。铜原子核外电子排布式为___。
(2)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是__,中心原子杂化类型为__。
②X的沸点比水低的主要原因是__。
(3)[Cu(NH3)4]2+中,提供孤对电子的是__。Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是__(填“极性”或“非极性”)分子,由此推知[Cu(NH3)4]2+的空间构型是__。
(4)某镍白铜合金的立方晶胞结构如图所示。
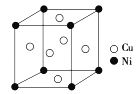
①晶胞中铜原子与镍原子的数量比为__。
②若合金的密度为dg·cm-3,晶胞边长a=__nm。(设NA代表阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是
A.平衡时,体系内含NO2为0.04mol·L-1
B.平衡时,N2O4的转化率为60%
C.前2s,N2O4的平均反应速率为0.005mol·L-1·s-1
D.在2s时,体系内压强为反应前的1.1倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(9分)某化学兴趣小组对生石灰与水反应是显著放热反应进行了实验探究,在除了用手触摸试管壁感觉发热外,还设计了下列几个可行性方案。
甲方案:将温度计与盛放有生石灰的小试管用橡皮筋捆绑在一起,放入有水的小烧杯中,用胶头滴管向小试管中缓缓滴入水,看到的现象是 ,说明反应放热。(下列装置中支撑及捆绑等仪器已略去)

乙方案:将盛放有生石灰的小试管插入带支管的试管中,支管接①或②,用胶头滴管向小试管中缓缓滴入水,看到的现象是(接①) ,(接②) ,说明反应放热。
丙方案:用胶头滴管向盛放有生石灰且带支管的试管中滴加水,支管接的导管中盛适量无水硫酸铜粉末,看到的现象是 ,说明反应放热,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两池中的电极材料都是铁棒与碳棒,请回答下列问题。
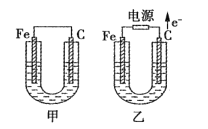
(1)若两池中的电解质溶液均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的__棒,乙池中的__棒。
②乙池中阳极的电极反应式是__。
(2)若两池中的电解质溶液均为饱和NaCl溶液:
①乙池中总反应的离子方程式为__。
②乙池中碳棒上的电极反应属于__(填“氧化反应”或“还原反应”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题目要求,回答下列问题:
(1)下列现象和应用与电子跃迁无关的是___。
A.激光 B.焰色反应 C.燃烧放热 D.原子光谱
(2)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用__形象化描述。
(3)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)__I1(Cu)(填“大于”或“小于”)。原因是__。
(4)ZnF2具有较高的熔点(872℃),其化学键类型是___;
(5)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为___,![]() 原子的杂化形式为__。
原子的杂化形式为__。
(6)与H2O分子互为等电子体的阴离子为__。
(7)[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为__。
(8)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g) ΔH=-313kJ/mol,F—F键的键能为159kJ/mol,Cl—Cl键的键能为242kJ/mol,则ClF3中Cl—F键的平均键能为__kJ/mol。ClF3的熔、沸点比BrF3的__(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是

A. 图甲表示反应:4CO(g)+2NO2(g)![]() N2(g)+4CO2(g)ΔH <0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2
N2(g)+4CO2(g)ΔH <0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1>T2,K1>K2
B. 图乙表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(g)的影响,乙的压强比甲的压强大
3C(g)+D(g)的影响,乙的压强比甲的压强大
C. 图丙表示的反应是吸热反应,该图表明催化剂不能改变化学反应的焓变
D. 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)![]() N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com