
| 步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解.往试管中加入 | 现象:溶液中产生大量白色沉淀; 结论: |
| 步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入 | 现象: 结论:样品中含有NaHCO3. |
| 步骤三:将步骤二的浊液过滤,取滤液于试管C中, | 现象: 结论: |
| 过量的Ba(NO3)2溶液 | 试样中含有Na2CO3. |
| 适量的NaOH溶液 | 有少量白色沉淀生成. |
| 先加入足量的稀硝酸,再加入少许AgNO3溶液 | 有少量白色沉淀生成;试样中含有NaCl. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2?H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
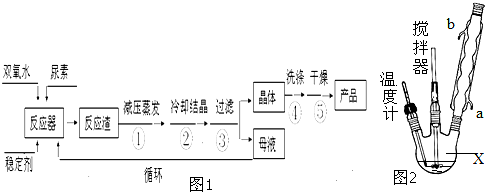
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验目的 |
| A | 在溴苯和溴的混合物中加入NaHSO3溶液振荡 | 除去溴苯中含有的溴杂质 |
| B | 向NaBr、KI溶液中加适量Cl2的CCl4溶液, 充分振荡后静置 | 比较Cl2、Br2、I2的氧化性强弱 |
| C | 测定熔融状态下某物质能否导电 | 确定结构中是否含有共价键 |
| D | 向蛋白质溶液中加入适量AgNO3溶液 | 除去蛋白质溶液中的NaCl杂质 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 5 |
| A、2:3 | B、3:2 |
| C、1:4 | D、1:6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com