


科目:高中化学 来源: 题型:

| A、图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B、图2表示0.1000 mol?L-1NaOH溶液滴定20.00mL0.1000 mol?L-1CH3COOH溶液所得到的滴定曲线 |
| C、图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D、图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v逆>v正 |
查看答案和解析>>
科目:高中化学 来源: 题型:
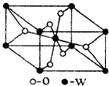 原子序数小于36的X、Y、Z、W四种元素,原子序数依次增大.其中X元素的一种核素的质量数为12,中子数为6; Y是空气中含量最多的元素;Z的基态原子核外5 个轨道上填充了电子,且有2个未成对电子;W的原子序数为22.
原子序数小于36的X、Y、Z、W四种元素,原子序数依次增大.其中X元素的一种核素的质量数为12,中子数为6; Y是空气中含量最多的元素;Z的基态原子核外5 个轨道上填充了电子,且有2个未成对电子;W的原子序数为22.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
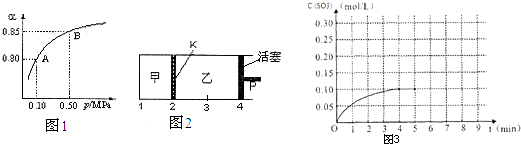
查看答案和解析>>
科目:高中化学 来源: 题型:
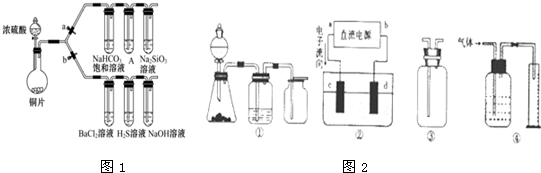
| 滴加的溶液 | 氯 水 | 氨 水 |
| 沉淀的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解.往试管中加入 | 现象:溶液中产生大量白色沉淀; 结论: |
| 步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入 | 现象: 结论:样品中含有NaHCO3. |
| 步骤三:将步骤二的浊液过滤,取滤液于试管C中, | 现象: 结论: |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com