
����Ŀ��300 ��ʱ����2 mol A��2 mol B������������2 L�ܱ������У��������·�Ӧ��3A(g)��B(g)![]() 2C(g)��2D(g)����H��2 minĩ�ﵽƽ�⣬����0.8 mol D��
2C(g)��2D(g)����H��2 minĩ�ﵽƽ�⣬����0.8 mol D��
��1��300 ��ʱ���÷�Ӧ��ƽ�ⳣ������ʽΪ��K��_______����֪K300 ��<K350 ��������H______0������>������<������
��2����2 minĩʱ��B��ƽ��Ũ��Ϊ_______��D��ƽ����Ӧ����Ϊ_______��
��3�����¶Ȳ��䣬��С�����ݻ�����A��ת����______������������ ����С����������������ԭ����_______��
��4���������ͬ�������£�������Ӧ���淴Ӧ������У���ʼʱ����C��D��4/3 mol����ʹƽ��ʱ�����ʵ����ʵ���Ũ����ԭƽ����ͬ����Ӧ�ü���B_______mol��
���𰸡�![]() > 0.8 mol��L-1 0.2 mol��(L��min) -1 ���� ��Ӧǰ������������䣬ѹǿ��ƽ����Ӱ�� 4/3
> 0.8 mol��L-1 0.2 mol��(L��min) -1 ���� ��Ӧǰ������������䣬ѹǿ��ƽ����Ӱ�� 4/3
��������
��1������ƽ�ⳣ���Ķ�����д����ʽ�������¶�ƽ�ⳣ������˵������ƽ�������ƶ���
��2������![]() �������ʣ�
�������ʣ�
��3�����¶Ȳ��䣬��С�����ݻ���ƽ��������ϵ����С�ķ����ƶ���
��4�����ݡ�һ�ߵ���ԭ���ϵ�Чƽ��˼����㣻
��1��3A(g)��B(g)![]() 2C(g)��2D(g)��ƽ�ⳣ��=
2C(g)��2D(g)��ƽ�ⳣ��=![]() �������¶�ƽ�ⳣ������˵������ƽ�������ƶ�����������Ӧ���ȣ���H>0��
�������¶�ƽ�ⳣ������˵������ƽ�������ƶ�����������Ӧ���ȣ���H>0��
��2��2 minĩ�ﵽƽ�⣬����0.8 mol D�����ݷ���ʽ��֪����0.4molB��B��ƽ��Ũ��Ϊ![]() 0.8 mol��L-1��D��ƽ����Ӧ����Ϊ
0.8 mol��L-1��D��ƽ����Ӧ����Ϊ![]() =0.2 mol��(L��min) -1��
=0.2 mol��(L��min) -1��
��3�����¶Ȳ��䣬��С�����ݻ���ƽ��������ϵ����С�ķ����ƶ��� 3A(g)��B(g)![]() 2C(g)��2D(g) ��Ӧǰ������������䣬ѹǿ��ƽ����Ӱ�죬��С�����ݻ�ƽ�ⲻ�ƶ�����A��ת���ʲ��䣻
2C(g)��2D(g) ��Ӧǰ������������䣬ѹǿ��ƽ����Ӱ�죬��С�����ݻ�ƽ�ⲻ�ƶ�����A��ת���ʲ��䣻
��4������ʼʱ����C��D��![]() mol�����ݻ�ѧ����ʽ���൱�ڼ�����2mol A��
mol�����ݻ�ѧ����ʽ���൱�ڼ�����2mol A��![]() mol B��ԭƽ�����2 mol A��2mol B�����Ի������
mol B��ԭƽ�����2 mol A��2mol B�����Ի������![]() molB��
molB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�У����ǵ�ⱥ��ʳ��ˮ������ͭ�ĵ�⾫�������ǵ�ƣ��ش�

��1��b���ϵĵ缫��ӦʽΪ__����ص��ܷ�Ӧ��ѧ����ʽ��__��
��2���ڴ�ͭ�ĵ������У�ͼ��c�缫�IJ�����__�����ͭ�塱��ͭ�塱������d�缫�Ϸ����ĵ缫��ӦΪ__������ͭ�л�����Au��Ag��Fe�����ʣ�������ڵ��۵ײ��������ࣩ��������__�����һ��ʱ����Һ�еĽ���������__��
��3�����Ҫ������Ʒ�϶��������۽��������ԭ������59������f�缫�IJ�����__�������Ʒ�������顱����ͬ����e�缫�IJ�����__��
��4����e�缫�������仯118 g����a�缫�ϲ����������ڱ�״���µ����Ϊ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�Ż��������Ҫ�ɷ���FexS(SΪ-2��)���Ⱥ���Fe2+�ֺ���Fe3+ ����һ�����ĸôŻ�������l00 mL������ǡ����ȫ��Ӧ��ע����ʯ�������ɷֲ������ᷴӦ��������2.4 g���ʡ�0. 425 mol FeCl2��һ����H2S���壬����Һ����Fe3+��������˵������ȷ����
A.����������ʵ���Ũ��Ϊ8.5 mol/L
B.���ɵ�H2S�����ڱ�״���µ����Ϊ9.52 L
C.�ôŻ�����FexS�У�x=0. 85
D.�ôŻ�����FexS�У�Fe2+�����ʵ���Ϊ0. 15mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() Ũ�����
Ũ�����![]() ͭ��Ӧ��ͭ��ȫ�ܽ⣬���ɵ�������ɫ�����dz
ͭ��Ӧ��ͭ��ȫ�ܽ⣬���ɵ�������ɫ�����dz![]() ����
����![]() ��
��![]() �����ռ���
�����ռ���![]() ����
����![]() ��״��
��״��![]() ��ʣ������NaOH�кͣ�����ȥ
��ʣ������NaOH�кͣ�����ȥ![]() ��������
��������![]() ����Ũ
����Ũ![]() ���ʵ���Ũ��Ϊ
���ʵ���Ũ��Ϊ![]()
![]()
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ��(��Ҫ�ɷ�CuFeS2)����ȡCu����Ҫԭ�ϡ�
��֪��2CuFeS2+4O2![]() Cu2S+3SO2+2FeO����
Cu2S+3SO2+2FeO����
����Cu2S��1200 ������¼�����Ӧ��2Cu2S+3O2==2Cu2O+2SO2 ����
2Cu2O+Cu2S==6Cu +SO2�� ������
�ٶ�������Ӧ����ȫ��������˵����ȷ����
A. ��Ӧ����CuFeS2������ԭ��
B. ȡ12.5g��ͭ����Ʒ�����ⶨ��3.60g���������CuFeS2��������һ��Ϊ82.8%
C. ��6molCuFeS2����6molCu����O2�����ʵ���Ϊ14.25mol
D. 6molCuFeS2��15.75molO2��Ӧ�������Ͽɵõ�ͭ�����ʵ���Ϊ3mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶���,��2 L���ܱ�������,X��Y��Z�������������ʱ��仯��������ͼ��ʾ:

(1)�ӷ�Ӧ��ʼ��10 sʱ,��Z��ʾ�ķ�Ӧ����Ϊ����������������,X�����ʵ���Ũ�ȼ�������������,Y��ת����Ϊ������
(2)�÷�Ӧ�Ļ�ѧ����ʽΪ��
(3)10 s���ijһʱ��(t1)�ı����������,��������ʱ��ı仯ͼ����ͼ��ʾ:

������˵�����ϸ�ͼ���������������
A.t1ʱ��,������X��Ũ�� B.t1ʱ��,��������ϵ�¶�
C.t1ʱ��,��С��������� D.t1ʱ��,ʹ���˴���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ�ʪ����������У��ֹ���Ҫ����������ʴ���й�������ʴ�Ļ����ж��֣�����һ������Ϊ����ϸ���ɴ�ʹSO42-��H2��Ӧ����S2-�����ٸֹܵĸ�ʴ���䷴Ӧԭ����ͼ��ʾ������˵����ȷ���ǣ� ��

A. �����ĵ缫��ӦʽΪ��2H2O+O2+4e-=4OH-
B. SO42-��H2�ķ�Ӧ�ɱ�ʾΪ��4H2+SO42--8e S2-+4H2O
S2-+4H2O
C. �ֹܸ�ʴ��ֱ�Ӳ����к���FeS��Fe��OH��2
D. �ڸֹܱ����п��ͭ�ɼ����ֹܵĸ�ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ˮ�г�����һ������Cr2O72����CrO42�������ǻ�����༰��̬ϵͳ�����ܴ���������д��������õĴ������������֡�
����1����ԭ������
�÷��Ĺ�������Ϊ��CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3��
Cr(OH)3��
���е���������ƽ�⣺2CrO42��(��ɫ)+2H��![]() Cr2O72��(��ɫ)+H2O
Cr2O72��(��ɫ)+H2O
(1)��ƽ����ϵ��pH=2������Һ��ɫ_________��
(2)��˵����������Ӧ��ƽ��״̬����___________��
A��Cr2O72����CrO42����Ũ����ͬ B��2v(Cr2O72��)=v(CrO42��) C����Һ����ɫ����
(3)�������У���ԭ1mol Cr2O72�����ӣ���Ҫ_________mol��FeSO47H2O��
(4)���������ɵ�Cr(OH)3����Һ�д������³����ܽ�ƽ�⣺Cr(OH)3(s)![]() Cr3+(aq)+3OH(aq),�����£�Cr(OH)3���ܶȻ�Ksp=c(Cr3+)��c3(OH)=1032��Ҫc(Cr3+)����105mol/L����Һ��pHӦ����_________________��
Cr3+(aq)+3OH(aq),�����£�Cr(OH)3���ܶȻ�Ksp=c(Cr3+)��c3(OH)=1032��Ҫc(Cr3+)����105mol/L����Һ��pHӦ����_________________��
����2����ⷨ
�÷���Fe���缫��⺬Cr2O72�������Է�ˮ�����ŵ����У�������������ҺpH���ߣ�����Cr(OH)3������
(5)��Fe���缫��ԭ��Ϊ____________��
(6)������������ҺpH���ߵ�ԭ����__________(�õ缫��Ӧ����)����Һ��ͬʱ���ɵij�������_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ϊ1L���ܱ�������![]() �������
�������![]() ����
����![]() ��
��![]() ��һ�������·�����Ӧ��
��һ�������·�����Ӧ��![]() �����
�����![]() ��
��![]() ��Ũ����ʱ��仯��ͼ��ʾ������˵����ȷ����
��Ũ����ʱ��仯��ͼ��ʾ������˵����ȷ����
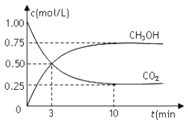
A.�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����Ϊ![]()
B.���е�3minʱ������Ӧ���ʺ��淴Ӧ�������
C.10min�������и����ʵ���Ũ�Ȳ��ٸı�
D.����ƽ��״̬ʱ����Ӧ�ų�![]() ������
������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com