
【题目】某化学兴趣小组测定某Fe2(SO4)3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取a g样品,置于烧杯中;
②加入50 mL 1.0 mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.0 mL溶液;
③量取25.0 mL步骤②中配得的溶液,置于烧杯中,加入适量氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑥……
请根据上面叙述,回答:
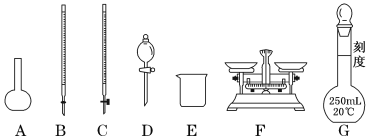
(1)上图所示仪器中,步骤①②③中必须用到的仪器有E和___________(填字母)。
(2)步骤②中:配制50 mL 1.0 mol/L稀H2SO4,需要用量筒量取98%(密度1.84 g/cm3)的浓H2SO4体积为________ mL。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
____Fe2++ ClO2+ === Fe3++ Cl-+ H2O
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果的影响是__________(填“偏大”“偏小”或“不影响”),等物质的量ClO2与Cl2的氧化效率之比为__________。
(4)若步骤⑤不在干燥器中冷却,则测定的铁元素的质量分数会________(填“偏大”“偏小”或“不影响”)。
【答案】CFG 2.7 5 1 4H+===5 1 2 不影响 5∶2 偏大
【解析】
根据氧化还原反应的本质和特征分析解答;根据一定物质的量浓度溶液的配制操作及注意事项分析解答;根据常用物质的制备分析解答。
(1)称量药品用天平,氯化铁和氯化亚铁的水溶液都呈酸性,所以准确量取25.00mL步骤②中配得的溶液用酸式滴定管,配制一定物质的量浓度的溶液用容量瓶,故答案为:CFG;
(2) 98%(密度1.84g/cm3)的浓H2SO4的物质的量浓度为:c(浓H2SO4)=![]() 18.4mol/L,依据稀释前后溶液溶质物质的量不变,故配制50mL,1.0mol/L稀H2SO4需要98%(密度1.84g/cm3)的浓H2SO4体积为c(浓)×V(浓)=c(稀) ×V(稀),带入计算得到:18.4mol/L× V(浓)=1.0mol/L×0.05L,即V(浓)=2.7mL,故答案为:2.7mL;
18.4mol/L,依据稀释前后溶液溶质物质的量不变,故配制50mL,1.0mol/L稀H2SO4需要98%(密度1.84g/cm3)的浓H2SO4体积为c(浓)×V(浓)=c(稀) ×V(稀),带入计算得到:18.4mol/L× V(浓)=1.0mol/L×0.05L,即V(浓)=2.7mL,故答案为:2.7mL;
(3) 反应中,Fe2+转化为Fe3+,ClO2中氯元素化合价从+4价变化为-1价,变化5价,电子转移最小公倍数为5,依据电子守恒和原子守恒配平得到离子方程式为:5Fe2++ClO2+4 H+═5Fe3++Cl-+2H2O;从理论上分析,上述实验中若将氯水改为ClO2时对实验无影响,不同的是氧化剂不同,同量还原性物质被氧化需要失去电子相同;等物质的量的ClO2与Cl2的氧化效率之比为为转移电子数之比,ClO2~Cl-~5e-,Cl2~2Cl-~2e-,所以1molClO2与Cl2的氧化效率之比为5:2,故答案为:5Fe2++ClO2+4 H+═5Fe3++Cl-+2H2O , 不影响 ,. 5∶2 ;
(4) 若步骤⑤不在干燥器中冷却,会吸收空气中的水蒸气,称量的质量增大,则测定的铁元素的质量分数偏大,故答案为:偏大。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为VL的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
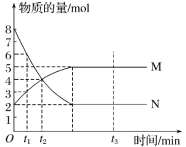
(1)此反应的化学方程式中![]() =____。
=____。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为_____。
(3)下列叙述能说明上述反应达到平衡状态的是____(填字母)。
A 反应中M与N的物质的量之比为1∶1
B 混合气体的总质量不随时间的变化而变化
C 混合气体的总物质的量不随时间的变化而变化
D 单位时间内消耗a mol N,同时生成b mol M
E 混合气体的压强不随时间的变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是以芳香烃A为原料合成有机高分子化合物甲和乙的路线图。
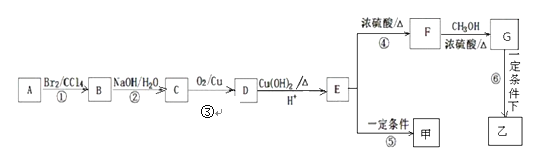
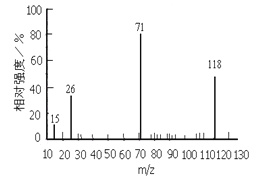
已知:①下图是A通过检测所得的质谱图,A分子中有5种不同化学环境的氢原子,它们的个数比为1:2:2:2:3;②甲乙均为有机高分子化合物;③A的分子结构中苯环上只有一个取代基。
请根据信息,回答下列问题:
(1)A的化学式为______;
(2)C中所含官能团的名称是_____;
(3)反应④的反应类型为_____;
(4)甲的结构简式为______;
(5)写出有关反应的化学方程式:③的反应方程式__________,⑥的反应方程式__________;
(6)含有苯环、与F具体相同官能团的F的同分异构体有____种(不考虑立体异构、不含F),其中核磁共振氢谱为5组峰,面积比为2:2:2:1:1的为_____(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据下列实验装置或实验描述,完成下列问题:
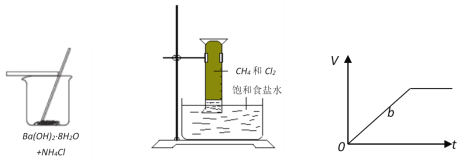
(1)图实验中烧杯壁变凉,说明该反应的△H___________0。
(2)图实验在光照下反应的现象是量筒内气体颜色变浅、_____________________。
(3)等质量的两份锌粉a、b,分别加入过量的稀H2SO4,同时向a中加入少量的CuSO4溶液,图表示b产生H2的体积(V)与时间(t)的关系。请在图中画出a产生H2的体积(V)与时间(t)的关系______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3+5O2=4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O)表示,则正确的关系是
A.4υ(NH3)=5υ(O2)B.5υ(O2)=6υ(H2O)
C.2υ(NH3)=3υ(H2O)D.4υ(O2)=5υ(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S2O3是一种弱酸,实验室欲用0.01 mol/L的Na2S2O3溶液滴定碘水,发生的反应为I2+2Na2S2O3===2NaI+Na2S4O6,下列说法正确的是( )
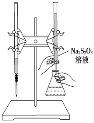
A. 该滴定反应可用甲基橙作指示剂
B. Na2S2O3是该反应的还原剂
C. 该滴定反应可选用如下图所示的装置
D. 该反应中每消耗2 mol Na2S2O3,转移电子的物质的量为4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的可逆反应:mA(g)+nB(g)![]() pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是( )
pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是( )
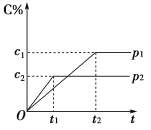
①p1>p2 ②p1<p2 ③m+n>p+q ④m+n=p+q ⑤m+n<p+q
A. ①③ B. ②③ C. ②⑤ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究物质性质的基本程序是一个系统化的过程,其主干可分为四个步骤.下列是研究物质性质的一般程序的第一步是
A. 预测物质性质 B. 观察物质的外观性质
C. 进行实验和观察 D. 做出有关的解释和结论
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列常用危险化学药品与对应的分类正确的是( )
①酒精——剧毒品 ②浓硫酸——腐蚀品 ③汽油——易燃品 ④液氯——放射性物品 ⑤高锰酸钾——氧化剂 ⑥黑火药——爆炸品
A.②③④⑥B.①②⑤C.①④⑤D.②③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com