
【题目】“84消毒液”广泛应用于杀菌消毒,其有效成分是NaClO。实验小组制备消毒液,并利用其性质探索制备碘水的方法。
资料:i.HClO的电离常数为Ka=4.7×10-8;
H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11。
ii.碘的化合物主要以I-和IO3-的形式存在,IO3-+5I-+6H+=3I2+3H2O。
iii.碘单质能与I-反应:I2+I-![]() I3-(I3-低浓度时显黄色,高浓度时为棕色)。
I3-(I3-低浓度时显黄色,高浓度时为棕色)。
Ⅰ.制备消毒液(夹持装置略)
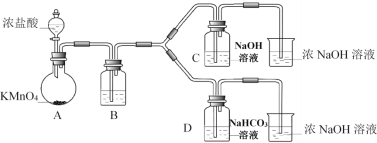
(1)制备NaClO消毒液的装置是__________(填C或D)。
(2)制备完成后,向C装置的溶液中添加NaOH、Na2SiO3等物质,得到与某品牌成份相同的消毒液,用平衡移动原理解释NaOH的作用___________________。
(3)结合资料i,写出D中反应的化学方程式______________________。
Ⅱ.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
方案 | 操作 | 现象 | 反应后加淀粉溶液 |
1 | 烧杯1溶液中加入9gKI固体 | 溶液为橙黄色 | …… |
2 | 烧杯2溶液中加入9gKI固体再加入1mo/L盐酸10mL | 溶液颜色快速加深,呈紫红色 | 变蓝 |
3 | 烧杯3溶液中加入少量KI固体(小于0.5g) | 振荡后溶液保持无色 | 不变蓝 |
(4)对比不同方案的实验现象,得出制取碘水的最佳方法要关注的因素是________。
(5)针对烧杯3“滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:过量的NaClO将反应生成的I2氧化为IO3-。
设计实验证实了假设1成立。NaClO氧化I2生成IO3-的离子方程式是_____________。
假设2:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设2成立,实验a的操作及现象是______________________。
(6)某小组检验烧杯3所得溶液中含IO3-:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在IO3-,说明理由______________________。
(7)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据________。
【答案】C ClO-+H2O![]() OH-+HClO,加入NaOH使c(OH-)增大,平衡逆移,使c(HClO)减小,分解速率减慢(或消毒液更稳定) Cl2+NaHCO3=HClO+NaCl+CO2 溶液的酸碱性;消毒液和KI的相对用量 5ClO-+I2+H2O=2IO3+5Cl-+2H+ 向与烧杯3pH相同的NaOH溶液中加入滴有淀粉溶液的碘水,振荡,蓝色褪去 不能,溶液中存在大量ClO的干扰,ClO也可将I氧化为I2使溶液变蓝 “变蓝,因为发生反应ClO+2I-+H2O=I2+Cl-+2OH-(和I2+I-
OH-+HClO,加入NaOH使c(OH-)增大,平衡逆移,使c(HClO)减小,分解速率减慢(或消毒液更稳定) Cl2+NaHCO3=HClO+NaCl+CO2 溶液的酸碱性;消毒液和KI的相对用量 5ClO-+I2+H2O=2IO3+5Cl-+2H+ 向与烧杯3pH相同的NaOH溶液中加入滴有淀粉溶液的碘水,振荡,蓝色褪去 不能,溶液中存在大量ClO的干扰,ClO也可将I氧化为I2使溶液变蓝 “变蓝,因为发生反应ClO+2I-+H2O=I2+Cl-+2OH-(和I2+I-![]() I3-),溶液中存在I2单质”或“变蓝,溶液显橙黄色,肯定存在有色离子I2或I3-,反应生成的I2存在平衡I2+I-
I3-),溶液中存在I2单质”或“变蓝,溶液显橙黄色,肯定存在有色离子I2或I3-,反应生成的I2存在平衡I2+I-![]() I3-,有I2会变蓝”;或“不变蓝,I2在碱性溶液中不存在,发生反应3I2+6OH-==IO3-+5I-+3H2O”
I3-,有I2会变蓝”;或“不变蓝,I2在碱性溶液中不存在,发生反应3I2+6OH-==IO3-+5I-+3H2O”
【解析】
(4)
(5)根据得失电子数目和原子守恒写出离子方程式。可通过向碱性溶液中加入淀粉溶液的碘水验证生成的I2在碱性溶液中不能存在。
(6)84消毒液中存在ClO,ClO具有氧化性,可将I氧化为I2,进而对实验产生干扰。
(7)结合题给资料iii进行分析,烧杯1可能出现变蓝、不变蓝或橙黄色,据此进行合理分析。
(1)分析题中Ⅰ.制备消毒液过程,该反应原理为:浓盐酸和KMnO4反应生成Cl2,然后Cl2与NaOH反应生成NaClO。实验中注意Cl2通入C装置前要进行除杂,则可知B装置中应盛有饱和食盐水,实验后要考虑尾气吸收问题。分析实验装置图,可知装置C为制备NaClO消毒液的装置。答案为:C;
(2)C装置生成了消毒液的主要成分——NaClO,ClO在水溶液中发生水解:ClO+H2O![]() HClO+OH,HClO不稳定易分解,故为了使消毒液保持稳定,应抑制ClO的水解,向其中加入NaOH,溶液中的OH浓度增大,使得ClO的水解平衡左移,进而达到稳定消毒液的目的,答案为:ClO+H2O
HClO+OH,HClO不稳定易分解,故为了使消毒液保持稳定,应抑制ClO的水解,向其中加入NaOH,溶液中的OH浓度增大,使得ClO的水解平衡左移,进而达到稳定消毒液的目的,答案为:ClO+H2O![]() OH+HClO,加入NaOH使c(OH)增大,平衡逆移,使c(HClO)减小,分解速率减慢(或消毒液更稳定);
OH+HClO,加入NaOH使c(OH)增大,平衡逆移,使c(HClO)减小,分解速率减慢(或消毒液更稳定);
(3)根据资料i,可知酸性:H2CO3>HClO>HCO3,Cl2与水发生反应生成HCl和HClO,根据酸性强弱可知,最终发生的反应为:Cl2+NaHCO3=HClO+NaCl+CO2。答案为:Cl2+NaHCO3=HClO+NaCl+CO2;
(4)分析Ⅱ中三个实验操作,方案2中生成了碘单质,对比三个实验方案的区别,可知成功制备碘水应注意两个因素:溶液的酸碱性;KI和消毒液的相对用量。答案为:溶液的酸碱性;消毒液和KI的相对用量;
(5)根据得失电子数目和原子守恒,可得出离子反应方程式为:5ClO+I2+H2O=2IO3+5Cl+2H+;可在碱性溶液中加入滴有淀粉溶液的碘水进行验证,实验操作为:向与烧杯3pH相同的NaOH溶液中加入滴有淀粉溶液的碘水,振荡,蓝色褪去;答案为:5ClO+I2+H2O=2IO3+5Cl-+2H+;向与烧杯3pH相同的NaOH溶液中加入滴有淀粉溶液的碘水,振荡,蓝色褪去;
(6)84消毒液的主要成分为NaClO,ClO具有氧化性,同样可以氧化I生成I2,进而干扰实验,故不能证明烧杯3中存在IO3-,答案为:不能,溶液中存在大量ClO的干扰,ClO也可将I氧化为I2使溶液变蓝;
(7)为了保证消毒液的稳定性,84消毒液中加入了NaOH等物质,结合题给资料iii进行变蓝,因为生成了I2;不变蓝,生成的I2又与OH发生了反应。故答案为:“变蓝,因为发生反应ClO+2I-+H2O=I2+Cl-+2OH-(和I2+I-![]() I3-),溶液中存在I2单质”或“变蓝,溶液显橙黄色,肯定存在有色离子I2或I3-,反应生成的I2存在平衡I2+I-
I3-),溶液中存在I2单质”或“变蓝,溶液显橙黄色,肯定存在有色离子I2或I3-,反应生成的I2存在平衡I2+I-![]() I3-,有I2会变蓝”;或“不变蓝,I2在碱性溶液中不存在,发生反应3I2+6OH-==IO3-+5I-+3H2O”。
I3-,有I2会变蓝”;或“不变蓝,I2在碱性溶液中不存在,发生反应3I2+6OH-==IO3-+5I-+3H2O”。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】化合物Z是合成一种镇痛药的中间体,可通过如下反应制得。下列说法正确的是( )
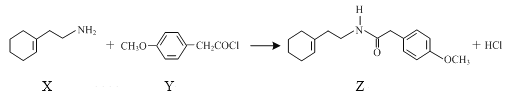
A.化合物X既能与盐酸反应,也能与NaOH溶液反应
B.化合物Y能使酸性KMnO4溶液褪色
C.化合物Z的分子式为C17H24O2N
D.化合物X与Br2加成所得产物分子中含有2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 聚乙烯不能使酸性KMnO4溶液褪色
B. ![]() 和
和 ![]() 均是芳香烃,
均是芳香烃,![]() 既是芳香烃又是芳香化合物
既是芳香烃又是芳香化合物
C. ![]() 和
和![]() 分子组成相差一个—CH2—,因此是同系物关系
分子组成相差一个—CH2—,因此是同系物关系
D. 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为C2H5-OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷(![]() )具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线:
)具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线:
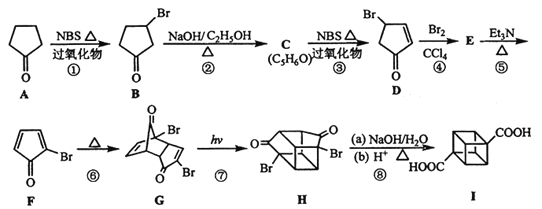
回答下列问题:
(1)C的结构简式为___________,E的结构简式为_______________。
(2)③的反应类型为___________,⑤的反应类型为_______________。
(3)化合物A可由环戊烷经三步反应合成,已知:反应1的试剂与条件为:Cl2/光照。
![]()
反应2的化学方程式为_____________________________________。
(4)在立方烷衍生物I的合成路线中,互为同分异构体的化合物是__________(填化合物代号)。
(5)立方烷衍生物I与碱石灰共热可转化为立方烷。立方烷的核磁共振氢谱中有________个峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
A. 0.5mol/LCuCl2溶液中含有的Cl-数目为NA
B. 42gC2H4和C4H8的混合气中含有氢原子数为6NA
C. 标准状况下,H2和CO混合气体4.48L在足量O2中充分燃烧消耗O2分子数为0.1NA
D. 在反应4Cl2+8NaOH=6NaCl+NaClO+NaClO3+4H2O中,消耗1molCl2时转移的电子总数为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况),实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大_______min(填0~1、1~2、2~3、3~4、4~5)。反应开始后反应速率先增大的原因是________________。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率_______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入少量的下列溶液以减慢反应速率,你认为不可行的是_______
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图
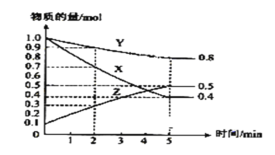
①该反应的化学方程式是____________。
②该反应达到平衡状态的标志是_________。
A.X、Y、Z的反应速率相等 B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变 D.生成1mol Y的同时生成2mol Z
③2min内X的转化率为__________。
④平衡后z所占的体积分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu组成的原电池示意图,某小组做完该实验后,在读书卡片上记录如下,卡片上描述合理的是( )
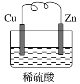
实验记录:
①导线中电流方向:Zn→Cu
②Cu极上有气泡产生,发生还原反应
③锌片变薄
实验结论:
④Zn为正极,Cu为负极
⑤正极反应式:Cu-2e-=Cu2+,发生氧化反应
⑥H+向Cu极移动,SO42-向Zn极移动
A.②③⑥B.④⑤⑥
C.③④⑤D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(s) ![]() Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,始终保持温度不变,则下列说法正确的是
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,始终保持温度不变,则下列说法正确的是
A. n(OH-)增大B. n(Ca2+)增大C. c(Ca2+)不变D. c(H+)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com