
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况),实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大_______min(填0~1、1~2、2~3、3~4、4~5)。反应开始后反应速率先增大的原因是________________。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率_______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入少量的下列溶液以减慢反应速率,你认为不可行的是_______
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图
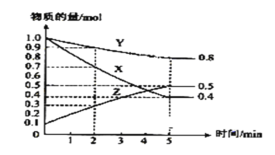
①该反应的化学方程式是____________。
②该反应达到平衡状态的标志是_________。
A.X、Y、Z的反应速率相等 B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变 D.生成1mol Y的同时生成2mol Z
③2min内X的转化率为__________。
④平衡后z所占的体积分数为__________。
【答案】2~3 该反应为放热反应,此时温度高,且盐酸浓度大,速率大 0.025mol·L-1·min-1 CD 3X+Y![]() 2Z CD 30% 29.4%
2Z CD 30% 29.4%
【解析】
(1)、①在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为100mL、
140mL、224mL、112mL、54mL,由此可知反应速率最大的时间段为2~3min;因为该反应是放热反应,开始阶段温庹对反应的速率起决定性的作用,温度越高,反应速率越大,故笞案为:2~3;该反应为放热反应,此时温度高,且盐酸浓度大,速率大;
②、在3~4in时间段内,n(H2)=0.112L/22.4L/mol=0.005mol,根据2HCl~H2,计算消耗盐酸的物质的量为0.01mol,则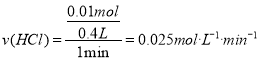 ,故答案为:0.025mol·L-1·min-1;
,故答案为:0.025mol·L-1·min-1;
(2)A.加入蒸馏水,H+浓度诚小,反应速率减小,且不减少产生氢气的量,故A可行;
B.加入KCl溶液,H+浓度减小,反应速率减小且不减少产生氢气的量,故B可行;
C.加KNO3溶液,H+浓度减小,因酸性溶液中有NO3-,具有强氧化性,与Zn反应无氢气生成,故C不可行;
D.加入CuS04溶液,Zn置换出Cu,反应速度增大,且影响生成氢气的量,故D不可行;故答案为:C D;
(3)①由图像可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物。当反应进行到5min时,△n(Y)=0.2mo1,△n(Z)=0.4mo1,△n(X)=0.6mo1,则
△n(Y):△n(Z):△n(X)=1:2:3,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为:3X+Y![]() 2Z,故答案为:3X+Y
2Z,故答案为:3X+Y![]() 2Z;
2Z;
②A.X、Y、Z的反应速率相等,不能说明是否变化,不能作平衡状态的标志,故A错误;B.随着反应的进行,X、Y的反应速率比始终为3:1,不能作为平衡状态的标志,故B错误;
C.体积固定,混合气体的总物质的量不确定,当容器的压强保持一定,说明正逆反应速率相等反应达到平衡状态,故C正确;
D.生成1mo1Y的同时生成2mo1Z,正逆反应速率相等,反应达到平衡状态,故D正确;故答案为:CD;
③2min内X的转化率为![]() ,故答案为:30%;
,故答案为:30%;
④由图像可知,平衡后X为0.4mol,Y为0.8mol,Z为0.5mol, 在相同的条件下,Z所占的体积分数为与物质的量分数相同,则平衡后Z所占的体积分数为![]() ,故本题答案为:29.4%。
,故本题答案为:29.4%。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德·埃特尔。他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法正确的是
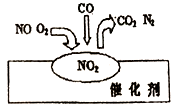
A.NO2是该过程的最终产物
B.NO 和O2必须在催化剂表面才能反应
C.汽车尾气的主要污染成分是CO2和NO
D.该催化转化的总反应方程式为:2NO+O2+4CO![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1molCH4和一定量Cl2组成的混合气体通入量筒中,将此量筒倒立在盛有饱和食盐水的水槽中,放在光亮处,回答下列问题:

(1)片刻后量筒中的现象:①量筒内气体的黄绿色变浅,②量筒内壁上出现_______________,③量筒内________________________________________。
(2)在反应结束后,量筒内的产物最多的是________,空间构型呈正四面体的产物为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”广泛应用于杀菌消毒,其有效成分是NaClO。实验小组制备消毒液,并利用其性质探索制备碘水的方法。
资料:i.HClO的电离常数为Ka=4.7×10-8;
H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11。
ii.碘的化合物主要以I-和IO3-的形式存在,IO3-+5I-+6H+=3I2+3H2O。
iii.碘单质能与I-反应:I2+I-![]() I3-(I3-低浓度时显黄色,高浓度时为棕色)。
I3-(I3-低浓度时显黄色,高浓度时为棕色)。
Ⅰ.制备消毒液(夹持装置略)
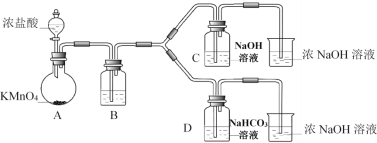
(1)制备NaClO消毒液的装置是__________(填C或D)。
(2)制备完成后,向C装置的溶液中添加NaOH、Na2SiO3等物质,得到与某品牌成份相同的消毒液,用平衡移动原理解释NaOH的作用___________________。
(3)结合资料i,写出D中反应的化学方程式______________________。
Ⅱ.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
方案 | 操作 | 现象 | 反应后加淀粉溶液 |
1 | 烧杯1溶液中加入9gKI固体 | 溶液为橙黄色 | …… |
2 | 烧杯2溶液中加入9gKI固体再加入1mo/L盐酸10mL | 溶液颜色快速加深,呈紫红色 | 变蓝 |
3 | 烧杯3溶液中加入少量KI固体(小于0.5g) | 振荡后溶液保持无色 | 不变蓝 |
(4)对比不同方案的实验现象,得出制取碘水的最佳方法要关注的因素是________。
(5)针对烧杯3“滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:过量的NaClO将反应生成的I2氧化为IO3-。
设计实验证实了假设1成立。NaClO氧化I2生成IO3-的离子方程式是_____________。
假设2:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设2成立,实验a的操作及现象是______________________。
(6)某小组检验烧杯3所得溶液中含IO3-:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在IO3-,说明理由______________________。
(7)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害。某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示。下列判断正确的是( )

A.在0~20min之间,pH=7时R的降解速率为7×10-2mol·L-1·min-1
B.R的起始浓度为1.5×10-4mol·L-1的降解速率大
C.在这三种pH条件下,二氧化钛对pH=2的R溶液催化降解效率最好
D.在0~50 min之间,R的降解百分率pH=2等于pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇广泛存在于食物(例如桑甚、花生,尤其是葡萄)中,它可能具有抗癌性。能够与1 mol该化合物发生反应的Br2和H2的最大用量分别是( )
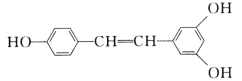
A.1mol、1molB.3.5mol、7mol
C.3.5mol、6molD.6mol、7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地球的表面积为5.1亿平方公里,其中海洋的面积为3.67亿平方公里,占整个地球表面积的70.8 %。海洋是一个巨大的化学资源宝库,下面是海水资源综合利用的部分流程图,请根据该图回答下列问题:
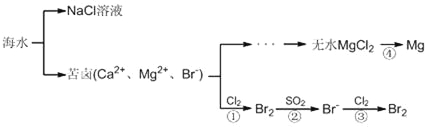
(1)淡化海水的方法有__________________(写一种合理方法即可)。由海水提取的粗盐中含有Ca2+、Mg2+、SO42-等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、________(填化学式),之后________(填操作名称),再加入适量________(填试剂名称)。将所得溶液加热浓缩、冷却结晶,得到精盐。
(2)反应④由无水MgCl2制取金属镁的常用工业方法是__________________。
(3)向苦卤中通入Cl2置换出Br2,再用空气吹出溴并用SO2吸收,转化为Br-,反复多次,以达到富集溴的目的。由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是_________________________。
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2。写出反应的离子方程式__________________________________。最后再用H2SO4处理所得溶液重新得到Br2,其反应的离子方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应![]() ,在容积固定的密闭容器中达到平衡状态的标志是( )
,在容积固定的密闭容器中达到平衡状态的标志是( )
①单位时间内生成![]() 的同时生成
的同时生成![]()
②单位时间内生成![]() 的同时生成
的同时生成![]()
③用![]() 表示的反应速率之比为
表示的反应速率之比为![]() 的状态
的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的物质的量不再改变的状态
A.①④⑥⑦B.②③⑤⑦C.①③④⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,中国科学院大连化物所“CO2催化转化为CO的研究”获得新进展。如图是使用不同催化剂(NiPc和CoPc)时转化过程中的能量变化,下列说法不合理的是( )
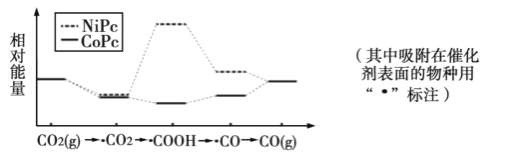
A.CO2经还原反应得到COOH
B.该研究成果将有利于缓解温室效应,并解决能源转化问题
C.相同基团的物种分别吸附在NiPc和CoPc表面,其能量可能不同
D.催化剂可以改变CO2转化为CO反应的焓变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com