
【题目】把1molCH4和一定量Cl2组成的混合气体通入量筒中,将此量筒倒立在盛有饱和食盐水的水槽中,放在光亮处,回答下列问题:

(1)片刻后量筒中的现象:①量筒内气体的黄绿色变浅,②量筒内壁上出现_______________,③量筒内________________________________________。
(2)在反应结束后,量筒内的产物最多的是________,空间构型呈正四面体的产物为________。
【答案】油状液滴 出现白雾、液面上升 HCl CCl4
【解析】
甲烷与氯气在光照下发生取代反应,消耗氯气,所以黄绿色变浅,由于产生的一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷都难溶于水,且后三个在常温下是液体,所以在量筒内壁有油状液滴,由于取代反应产生的HCl气体在水中溶解,所以量筒内液面上升,而且出现白雾。
(1)根据分析,片刻后量筒中的现象:①量筒内气体的颜色变浅②量筒壁上出现油状液滴,③量筒内出现白雾、液面上升。
(2)由于取代反应是逐步进行的,每一步取代反应都会产生HCl气体,所以在反应结束后,量筒内的产物最多的是HCl;生成的多种氯代物中,只有CCl4空间构型呈正四面体;


科目:高中化学 来源: 题型:
【题目】已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O。如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是

选项 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
C | 紫色石蕊溶液先变红后褪色 | Cl2具有漂白性 |
D | KI淀粉溶液变蓝色 | Cl2具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数小于等于36的Q、W、X、Y、Z五种元素原子序数依次增大,其中Q是原子半径最小的元素,W和Y的基态原子2p能级所含成单电子数均为2,Z的基态原子核外含有13种运动状态不同的电子。回答下列问题(涉及元素时用对应的元素符号表示):
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是___。
(2)1molQWX与1molWQ2Y所含σ键的比值为___。
(3)根据等电子体理论可以预测WXY-的空间构型为___。
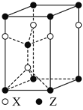
(4)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为___。
(5)实验室合成一种由W和X两种元素形成的化合物,该化合物具有空间网状结构,其中每个W原子与4个X原子形成共价键,每个X原子与3个W原子形成共价键。
①该化合物的化学式为___。
②该化合物所属晶体类型为___晶体,预测其熔点应___金刚石(填“高于”或“低于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 聚乙烯不能使酸性KMnO4溶液褪色
B. ![]() 和
和 ![]() 均是芳香烃,
均是芳香烃,![]() 既是芳香烃又是芳香化合物
既是芳香烃又是芳香化合物
C. ![]() 和
和![]() 分子组成相差一个—CH2—,因此是同系物关系
分子组成相差一个—CH2—,因此是同系物关系
D. 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为C2H5-OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中NOx的生成和消除是科学家研究的重要课题。
(1)NOx能形成酸雨,NO2转化为HNO3的化学方程式是__。
(2)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g) H=+180kJ·mol-1,其能量变化示意图如下:
![]()
则NO中氮氧键的键能是__kJ·mol-1。
(3)用NH3可消除NO污染,反应原理为:4NH3+6NO![]() 5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示:
5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示:
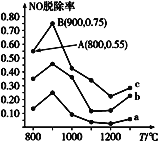
①曲线a对应的n(NH3):n(NO)=__。
②曲线c中NO的起始浓度为4×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为__mg/(m3·s)。
③由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降,可能的原因是__(至少写两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷(![]() )具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线:
)具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线:
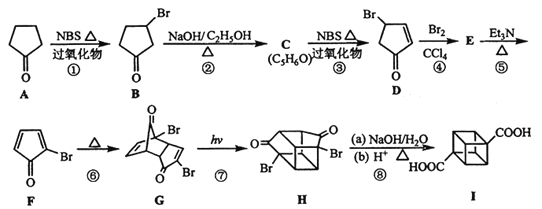
回答下列问题:
(1)C的结构简式为___________,E的结构简式为_______________。
(2)③的反应类型为___________,⑤的反应类型为_______________。
(3)化合物A可由环戊烷经三步反应合成,已知:反应1的试剂与条件为:Cl2/光照。
![]()
反应2的化学方程式为_____________________________________。
(4)在立方烷衍生物I的合成路线中,互为同分异构体的化合物是__________(填化合物代号)。
(5)立方烷衍生物I与碱石灰共热可转化为立方烷。立方烷的核磁共振氢谱中有________个峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况),实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大_______min(填0~1、1~2、2~3、3~4、4~5)。反应开始后反应速率先增大的原因是________________。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率_______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入少量的下列溶液以减慢反应速率,你认为不可行的是_______
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图
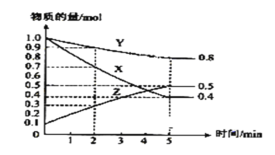
①该反应的化学方程式是____________。
②该反应达到平衡状态的标志是_________。
A.X、Y、Z的反应速率相等 B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变 D.生成1mol Y的同时生成2mol Z
③2min内X的转化率为__________。
④平衡后z所占的体积分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中“实验内容”与验应“现象或结论”关系都正确的是
选项 | 实验内容 | 实验现象或结论 |
A | 分别往 4 mL 0.01 mol/L 、4 mL 0.02 mol/L KMnO4溶液加入2 mL 0.1 mol/L H2C2O4 溶液,记录褪色时间 | 浓度越大,反应速率越快越先褪色 |
B | 以石墨为电极,电解 KI溶液 (其中含有少量酚酞) | 阴极逸出气体且附近溶液呈现红色 |
C | 25℃时,向 pH=l 的盐酸和醋酸各 0.5L的溶液中各加入 1.4g 铁粉 | 醋酸中生成H2的速率快且最终气体 量多 |
D | 向 FeCl3+3KSCN | 血红色变浅,说明增加生成物浓度, 平衡逆向移动 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com