
| n |
| V |
| n |
| V |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| △ |
| 足量的钠 |
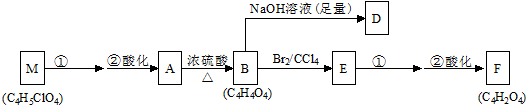
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+ Al3+ Mg2+ Ba2+ Fe3+ |
| 阴离子 | NO3- CO32- SiO32- SO42- OH- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
| 阴离子 | 浓度c/(mol?L-1) |
| ① | |
| ② | |
| ③ | |
| ④ | |
| ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据溶液中的金属离子和残留固体的成分最多会有5种情况 |
| B、若金属有剩余,在溶液中再滴入稀硫酸后,金属不会溶解 |
| C、当合金刚好溶解时,在标准状况下产生2.24LNO |
| D、若合金全部溶解,在溶液中加入过量的氨水,(已知铜离子可转化为四氨合铜络离子溶于水)则经过滤、洗涤、干燥、充分灼烧、称量可得固体4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阳极为纯净气体,阴、阳两极产生的气体体积比≤1:1 |
| B、阳极为纯净气体,阴、阳两极产生的气体体积比≥1:1 |
| C、阳极为混合气体,阴、阳两极产生的气体体积比≤1:1 |
| D、阳极为混合气体,阴、阳两极产生的气体体积比≥1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用肉眼观察区别溶液、胶体和浊液 |
| B、用BaCl2溶液鉴别Na2SO3是否变质 |
| C、用澄清石灰水鉴别Na2CO2溶液和NaHCO3溶液 |
| D、用NaOH除去Mg中混有的少量Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com