
【题目】图分别是A、B两种物质的核磁共振氢谱,已知A、B两种物质都是烃类,都含有6个氢原子,试根据两种物质的核磁共振氢谱推测A、B有可能是下面的
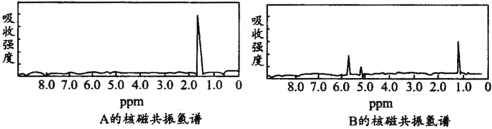
A.C3H6,C6H6B.C2H6,C3H6C.C6H6 ,C2H6D.C3H6,C2H6
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素,原子序数依次增大,A、E同主族,D、F同主族,A元素的原子半径是所有原子中最小的,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E、F五种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)F元素在周期表中的位置__________,在以上元素最高价氧化物的水化物中,碱性最强的化合物的电子式是:__________。
(2)D、F的气态氢化物,沸点较高的是___________(填分子式)。
(3)A单质与C单质在一定条件下可化合为Z,常温下,向pH=a的Z的水溶液中加入等体积pH=b的X的水溶液,且a+b=14,充分作用后,溶液pH______7(填“>”“<”或“=”),原因是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从镍矿石尾矿中提取NiSO4是解决我国镍资源匮乏的一条重要途径,已知该过程如下:
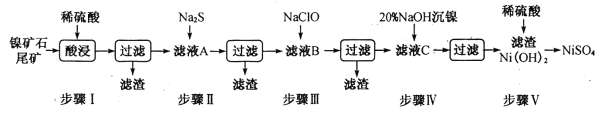
表1:各物质的Ksp数据如下表:
物质 | MnS | NiS | PbS | CuS | Ni(OH)2 |
Ksp | 2.5×10-13 | 1.1×10-21 | 8.0×10-28 | 6.3×10-36 | 2.0×10-15 |
表2:滤液A中各金属离子的含量如下表:
成分 | Ni2+ | Fe3+ | Fe2+ | Mn2+ | Cu2+ | Pb2+ | …… |
含量/g·L-1 | 3.80 | 4.80 | x | 0. 20 | 0.15 | <0.001 | …… |
根据以上信息,回答下列问题:
(1)步骤I酸浸之前需将矿石粉碎,目的是_______________。
(2)
(3)常温下进行步骤Ⅲ的目的是为了除去铁和锰元素,已知除铁元素的离子反应如下:2Fe2++ ClO - +5H2O=2Fe( OH)3↓+Cl- +4H+,此时Mn2+的氧化产物为MnO2,写出除锰元素的离子方程式_____________。
(4)所得Ni(OH)2是制造镍镉电池的重要原料,镍镉电池工作原理如下:Cd+2NiO(OH) +2H2O![]() Cd(OH)2+2Ni(OH)2,则随着放电的进行,正极区pH______(填“增大”、“减小”或“不变”);充电时阴极电极反应式为______________________。
Cd(OH)2+2Ni(OH)2,则随着放电的进行,正极区pH______(填“增大”、“减小”或“不变”);充电时阴极电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。在一定温度下,用 0.1 mol·L-1KOH溶液分别滴定体积均为 20 mL、浓度均为 0.1 mol·L-1的盐酸和醋酸溶液,滴定曲线如图所示。下列有关判断正确的是
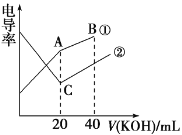
A.①表示的是 KOH溶液滴定盐酸溶液
B.A点的溶液中有c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L
C.C 点水电离的 c(OH-)小于 A 点水电离的 c(OH-)
D.在B点的溶液中有:c(CH3COO-)>c(K+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如图所示的实验装置,按要求回答下列问题。
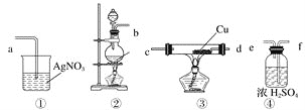
(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序:装置②→__________。
(2)装置②中主要玻璃仪器的名称__________、__________、__________。
(3)实验室制备Cl2的离子方程式为____________。
(4)装置③中Cu的作用__________(用化学方程式表示)。
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入__________。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到__________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一有机化学基础](13分)
对二甲苯(英文名称p-xylene,缩写为PX)是化学工业的重要原料。
(1)写出PX的结构简式 。
(2)PX 可发生的反应有 、 (填反应类型)。
(3)增塑剂(DEHP)存在如下图所示的转化关系,其中A 是PX的一种同分异构体。
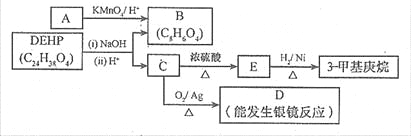
① B 的苯环上存在2 种不同化学环境的氢原子,则B 的结构简式是 。
② D 分子所含官能团是 (填名称)。
③ C 分子有1个碳原子连接乙基和正丁基,DEHP的结构简式是
(4)F 是B 的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;b.遇FeCl3溶液显示特征颜色;c.能与碳酸氢钠溶液反应。
写出F 与NaHCO3溶液反应的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速度来滴定该浓氯水,根据测定结果绘制出ClO-、ClO3-等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是( )

A.NaOH溶液和浓氯水可以使用同种滴定管盛装
B.a点溶液中存在如下关系:c(Na+) + c(H+) = c(ClO-)+ c(OH-)+ c(ClO3-)
C.b点溶液中各离子浓度:c(Na+) > c(Cl-) > c(ClO-) = c(ClO3-)
D.t2~t4,ClO-的物质的量下降的原因可能是ClO-自身歧化:2ClO-= Cl-+ ClO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿主要成分Al2O3,还含少量 SiO2、Fe2O3杂质。可用下图制备铝:
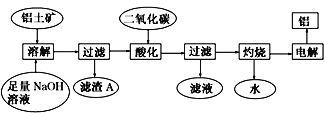
已知 2Na2SiO3+2NaAlO2+2H2O === Na2Al2Si2O8↓+4NaOH。 回答下列问题:
(1)在工艺流程第五步中,灼烧所需的实验仪器除酒精灯、坩埚、坩埚钳、玻璃棒之外,还需要_____________、_________________________。
(2)Na2Al2Si2O8的氧化物形式为_________________________。
(3)滤渣A经多步可制得粗硅 ,请写出由二氧化硅制得粗硅的化学方程式________________。
(4)在工艺流程第三步中,通入过量的二氧化碳时,该反应的离子方程式有_______________, 得到的滤液与足量Ba(OH)2溶液反应的主要离子方程式为 ____________________。
(5)将a g铝土矿经过以上一系列操作之后,最终得到b g Al(不考虑实验过程中操作引起的损耗), 下列说法正确的是____________。 (NA表示阿伏加德罗常数)
A.铝土矿中 Al3+数目小于![]()
B.铝土矿中Al2O3物质的量小于b/54 mol
C.铝土矿中铝元素的质量分数为![]() ×100℅
×100℅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O.已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+SO2(l)![]() SO32-+SO2+.若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是 ( )
SO32-+SO2+.若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是 ( )
A. 该滴定反应可以表示为:SO32-+ SO2+=2SO2
B. 在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C. 自离解的存在,说明SO2是离子化合物
D. 可通过导电能力变化来判断是否到达滴定终点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com