
【题目】硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,另含少量杂质FeCO3和SiO2等)为原料制备高纯氧化镁的实验流程如下:
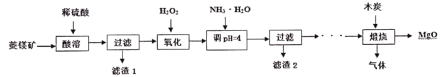
(1)MgCO3与稀硫酸反应的离子方程式是____________。
(2)加入H2O2氧化时,发生反应的离子方程式为____________________。
(3)煅烧过程存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
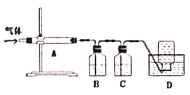
①A中现象是________,A中收集的物质可用热的NaOH溶液去除,写出该反应的化学反应方程式:__________________。
②B中盛放的溶液可以是_________(填字母)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.品红溶液 e.酸性KMnO4溶液
③D中收集的气体可以是________(填化学式)。
【答案】MgCO3+2H+=Mg2++CO2↑+H2O 2Fe2++2H++H2O2=2Fe3++2H2O A中有淡黄色固体附着 3S +6NaOH =△ Na2SO3+ 2Na2S+3H2O e CO
【解析】
根据流程图及题干信息分析每步发生的化学反应,进而判断滤渣、滤液的成分,书写离子放出式;根据装置图及题干信息分析图中装置的作用及盛放的试剂。
(1)MgCO3与稀硫酸发生复分解反应生成硫酸镁、二氧化碳和水,离子方程式是MgCO3+2H+=Mg2++CO2↑+H2O,
故答案为:MgCO3+2H+=Mg2++CO2↑+H2O;
(2)滤液中含有亚铁离子,加入H2O2氧化时,亚铁离子被氧化,离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,
故答案为: 2Fe2++2H++H2O2=2Fe3++2H2O;
(3)①根据题干信息知煅烧后生成黄色固体S,所以A中现象是有淡黄色固体附着;A中生成的物质有MgO和S,S与NaOH溶液反应的化学反应方程式:3S +6NaOH ![]() Na2SO3+ 2Na2S+3H2O;
Na2SO3+ 2Na2S+3H2O;
②煅烧产生的气体有二氧化硫、二氧化碳和一氧化碳,若进行分步吸收,则先利用二氧化硫的还原性用酸性高锰酸钾吸收,所以B中盛放的溶液可以是酸性高锰酸钾;
③产生气体中二氧化硫和二氧化碳被吸收,所以D中收集的气体可以是CO,
故答案为:A中有淡黄色固体附着;3S +6NaOH![]() Na2SO3+ 2Na2S+3H2O;e;CO。
Na2SO3+ 2Na2S+3H2O;e;CO。


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的值,下列说法正确的是
A. 32.5g锌粒与足量盐酸反应产生11.2 L H2
B. 标准状况下,11.2 L CCl4所含分子数为0.5NA
C. 1mol NaHSO4中含有的阴阳离子的总数目为 3NA
D. 常温常压下,40g O2和O3的混合气体中,含有氧原子的数目为2.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,水作还原剂的是
A. 2H2O+2F2=4HF+O2 B. 2Na2O2+2H2O=4NaOH+O2↑
C. 2Na+2H2O=2NaOH+H2↑ D. 2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 金属钠投入到足量的稀盐酸中: Na+2H+==Na++H2↑
B. CuO溶解在稀盐酸中:O2-+2H+==H2O
C. 氢氧化钡溶液与稀硫酸反应:Ba2++SO![]() +H++OH-== BaSO4↓+H2O
+H++OH-== BaSO4↓+H2O
D. 碳酸氢钙溶液与稀盐酸反应:HCO![]() +H+==H2O+CO2↑
+H+==H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯有四种常见的合成方法。己知A是一种单糖,广泛存在于带甜味的水果中,B是一种生活中常见的含氧有机物且式量为46,E是一种石油裂解产物,能做水果的催熟剂。它们之间的转化关系如下图:

请回答:
(1)有机物E中含有的官能团名称是________________ 。
(2)反应④的反应类型是__________________ 。
(3)有机物B在催化剂的作用下可直接转化为乙酸乙酯和另外一种常见气体,请写出该反应的化学方程式___________。
(4)下列说法正确的是___________。
A.有机物A不能使碘水变蓝
B.反应⑤是同分异构体之间的相互转换
C.有机物B、D和乙酸乙酯都是挥发性无色液体,可以通过闻气味进行鉴别
D.等质量的有机物A、D和乙酸乙酯充分燃烧,消耗氧气的质量也相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装罝如下图所示。请回答:

(1)装置A中分液漏斗内的物质是________________ 。
(2)实验时,旋开装置A中分液漏斗的旋塞,发现液体流出缓慢,最终停止,其可能的原因是___________________。
(3)实验过程中通入足量的SO2,请设计一个实验方案,验证SO2与FeCl3溶液反应的主要产物(H+无需检验)______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定对人类的生存发展具有重要意义,科学家一直致力于“人工固氮”的新方法研究。
(1)豆科植物的根瘤菌含有一种固氮酶,能在常温下将空气中的氮气转化为自身生长所需的含氮化合物,下列说法错误的是________(填标号)。
a.固氮酶是一种蛋白质
b.固氮酶能降低固氮反应发生所需的能量
c.固氮酶能使固氮反应的平衡正向移动
d.固氮酶能加快固氮反应的速率
(2)合成氨是目前最重要的固氮方法。下图为合成氨反应N2(g)+3H2(g)![]() 2NH3(g)在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积之比为1∶3时,平衡混合物中氨的体积分数的变化曲线如下图。
2NH3(g)在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积之比为1∶3时,平衡混合物中氨的体积分数的变化曲线如下图。
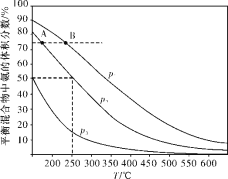
①A、B两平衡状态相比较,前者较大的是___________(填标号)。
a.平衡常数 b.平衡混合物的平均摩尔质量
c.氢气的转化率 d.从反应开始至达到平衡状态所需要的时间
②图中p1、p2、p3由大到小的顺序为_____________________。
③在250 ℃、p2下,H2的转化率为_____________%(结果保留小数点后一位)。
(3)据报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3和一种单质。已知:①H2(g)+![]() O2(g)===H2O(l) ΔH1=-285.6 kJ/mol,②N2(g)+3H2(g)
O2(g)===H2O(l) ΔH1=-285.6 kJ/mol,②N2(g)+3H2(g)![]() 2NH3(g) ΔH2=-92.2 kJ/mol,写出此条件下氮气和水反应的热化学方程式:________________。
2NH3(g) ΔH2=-92.2 kJ/mol,写出此条件下氮气和水反应的热化学方程式:________________。
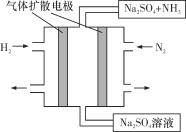
(4)下图为一种常温常压下水溶液中电化学合成氨的实验装置示意图。请据此写出其正极反应的电极反应式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 油脂在碱性条件下水解可生成高级脂肪酸盐和甘油
B. 淀粉、纤维素和蔗糖都属于糖类,一定条件下水解都只生成葡萄糖
C. 蛋白质在紫外线、CuSO4溶液、福尔马林作用下均会发生变性
D. 二氧化碳和环氧丙烷(![]() )在催化剂作用下可生成一种可降解的塑料
)在催化剂作用下可生成一种可降解的塑料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法不正确的是
A. 物质的量浓度相同的NaOH溶液和氨水:c(Na+)>c(NH4+)
B. 物质的量浓度相同的盐酸和醋酸溶液,前者c(OH-)更小
C. 将相同体枳相同物质的量浓度的NaOH溶液和醋酸溶液混合后呈碱性,说明醋酸是弱电解质
D. pH=3的盐酸和pH=11的氨水混合后pH>7,说明氨水是弱电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com